TEMPERATURES
D'EBULLITION
Tableau comparatif des températures
d'ébullition des alcanes, alcools, acides
carboxyliques, et des esters méthyliques de ces acides, saturés et non ramifiés
ayant le même nombre d'atomes de carbone dans leur chaîne.
N.B:
Lorsqu'une température d'ébullition
se présente sous la forme 227100 cela veut dire 227°C sous la
pression de 100 mm de Hg.
360d indique que le
corps se décompose à cette température.
|
Nombre de carbones |
alcane non ramifié (°C) |
alcool
|
acide
|
ester méthylique |
* |
Nombre de carbones |
alcane |
alcool
|
acide
|
ester méthylique |
|
C1 |
-161,7 |
65 |
100,7 |
31,5 |
* |
C11 |
195,8 |
243 |
280 undécanoïque |
245 |
|
C2 |
-88,6 |
78,5 |
117,9 |
57 |
* |
C12 |
216,3 |
255 |
1311 laurique |
262766 |
|
C3 |
-42,1 |
97,4 |
141 |
79,9 |
* |
C13 |
235,4 |
15214 |
236100 tridécanoïque |
901 |
|
C4 |
-0,5 |
117,2 |
165,5 |
102,8 |
* |
C14 |
253,7 |
263,2 |
250,5100
Myristique |
295751 |
|
C5 |
36,1 |
137,3748 |
186 |
127,4 |
* |
C15 |
270,6 |
257100 pentadécanoïque |
153,5 |
|
|
C6 |
68,7 |
158 |
205 caproïque |
149,5 |
* |
C16 |
287 |
19015 |
350 Palmitique |
415747
|
|
C7 |
98,4 |
176 |
223 |
174 |
* |
C17 |
301,8 |
308 |
227100
|
1859 |
|
C8 |
125,7 |
194,4 |
239,3 |
192,9 |
* |
C18 |
316,1 |
210,515 |
360d
stéarique |
442747
|
|
C9 |
150,8 |
213,5 |
255 |
213-14757 |
* |
C18
|
alcène |
205 |
286100
|
218,520 |
|
C10 |
174,0 |
229 |
270 caprique |
224 |
* |
C19 |
329,7 |
1660,32 |
297100 nonadécanoïque |
1904 |
La température
d'ébullition d'un liquide est en relation avec le "degré"
d'association des molécules entr'elles dans le liquide. Plus elles sont
solidement liées et plus il faut d'énergie pour les rompre et pour
séparer les molécules donc pour faire passer le liquide à l'état de vapeur.
L' examen de
ces courbes appelle quelques remarques:
- La température d'ébullition des alcanes augmente avec le nombre de carbones de la molécule ; cela vient du fait que les forces de London (influence des nuages électroniques de deux molécules non polaires voisines, qui se corrèlent en créant une attraction) augmentent avec la longueur de la chaîne carbonée. L'augmentation de la masse de la molécule est aussi un facteur d'augmentation de l'énergie (cinétique) nécessaire pour faire "sortir" ces molécules du liquide.
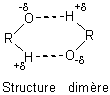
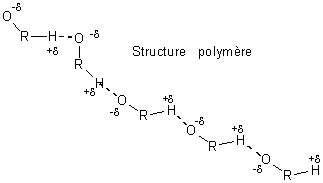
- Les alcools (on a pris ici des alcools non ramifiés et 1-ol) ont
une température d'ébullition supérieure aux alcanes ayant le même nombre
d'atomes de carbone ; cela est dû aux liaisons hydrogène qui
existent entre les molécules d'alcool à l'état liquide et qui n'existent pas entre
les molécules d'alcanes. Ces liaisons résultent de la forte polarisation de la
liaison O-H qui entraîne l'apparition de charges partielles importantes
sur O (-d) et sur H (+d). Il se crée des associations de
nature électrostatique entre l'O d'une molécule et l'H d'une molécule voisine
soit de type dimère soit de type polymère. Ces liaisons sont beaucoup moins
fortes que les liaisons covalentes, mais suffisantes pour élever notablement la
température d'ébullition des alcools.
- Les acides
carboxyliques ont une température d'ébullition très supérieure aux alcanes et
supérieure aux alcools ayant le même nombre d'atomes de carbone; ils sont encore plus
fortement liés que les alcools par des liaisons hydrogène et sont en majeure
partie sous forme de dimères.
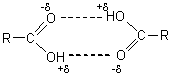
- L'augmentation
du nombre de carbones dans la chaîne, tend à diminuer l'écart entre les points
d'ébullition des alcanes, des alcools et des acides ayant le même nombre
d'atomes de carbone.L'importance de l'influence des liaisons hydrogènes
diminue.
- La courbe des esters méthyliques des acides carboxyliques se confond pratiquement avec celle des alcools qui ont le même nombre d'atomes de carbone que les acides qui ont donné naissance à ces esters.