QUESTIONNAIRE 72
Corrigé
ENONCE :
Une masse de 5,6g d'un alcène monoéthylénique fixe
16g de dibrome.
1) Quelle est la formule brute de cet alcène ?
2) L'oxydation à chaud par une solution concentrée
de permanganate de potassium conduit à la formation de dioxyde de carbone et de
propanone. Quelle est la formule développée plane de cet alcène ?
CORRIGE
1) L'addition de dibrome sur un alcène monoéthylénique se fait mole à mole suivant le schéma :
cela correspond à m = 2*MBr =160g de dibrome ; ici
on fixe 16g de dibrome soit 0,1 mol de dibrome correspondant à 0,1 mol d'alcène qui a pour masse
5,6g. Sa masse molaire moléculaire est donc M = 56g.mol-1.
Formule générale d’un alcène : CnH2n.
Masse molaire correspondante : M=(12xn) + (1x2n)=14n
Sachant que dans ce cas M=56 = 14n on en déduit n=56/14=4 d’où
sa formule moléculaire brute : C4H8.
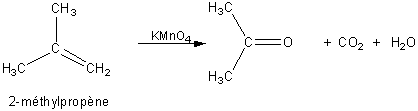
2) L'oxydation par le permanganate concentré à chaud entraîne la coupure de la
molécule au niveau de la double liaison. Après oxydation un « fragment » de
l'alcène correspond à la propanone l'autre au dioxyde de carbone, la molécule
permettant de parvenir à ce schéma est donc :