PURIFICATION D'UN SOLIDE PAR
RECRISTALLISATION
1) But et principe de la
méthode:
1-1) But:
Un composé S cristallisé, que l'on vient de
préparer, est brut.
Il contient des impuretés solides A,B,C,et
D. Pour le purifier, c'est-à-dire le débarrasser de ses
impuretés, on le "lave" (par exemple avec de l'eau) pour enlever les
impuretés (par exemple C et D) trés solubles dans l'eau à froid.Puis, pour
enlever les impuretés A et B, il faut utiliser un solvant, qui :
- doit facilement dissoudre A et B à froid et à chaud.
-doit dissoudre facilement S à chaud, mais
très peu à froid.
Outre ces qualités, le solvant de recristallisation
ne doit pas réagir avec le produit préparé, il doit être assez volatil (son
point d'ébullition doit être inférieur au point de fusion du produit préparé),
il doit être le moins onéreux possible.
1-2) Principe:
- On solubilise le produit brut (l'ensemble S+A+B) à chaud dans
le minimum de solvant
- On laisse refroidir le tout (air, puis eau puis eau glaçée)....seul S
précipite; on filtre.
Remarque:
il est important d'utiliser le minimum de solvant si l'on veut avoir un bon
rendement, car S est toujours plus ou moins soluble, à froid dans le solvant.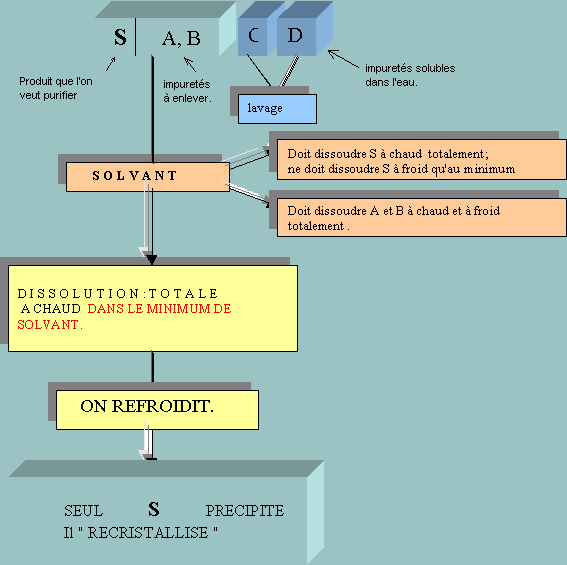
2) Réalisation :
- le solvant n'est pas volatil, ni inflammable, ni toxique (en pratique, on
dira le solvant est l'eau) :
on travaille dans un erlenmeyer.
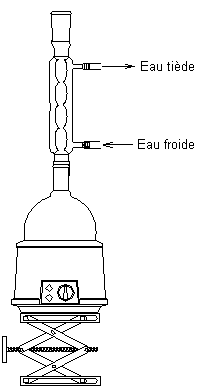
- le solvant est volatil, toxique ou inflammable, on travaille avec un montage à reflux: