LES ALCANES
- Formule brute
- Structure
- Groupes dérivés
- Nomenclature
- Quelques alcanes
- Propriétés physiques
- Propriétés chimiques
- Résumé
- Formule brute :
CnH2n+2
- Structure :
Ce sont
des hydrocarbures acycliques saturés:
 Le méthane (orbitales moléculaires)
Le méthane (orbitales moléculaires)
*
hydrocarbures : leur molécule n'est composée que de deux éléments : C et H.
* saturés : tous les atomes de carbone sont
tétragonaux (dc-c = 0,154 nm angles autour d'un C :109°28')
* acycliques: les chaînes carbonées ne sont pas
fermées.
- Groupes dérivés :
En enlevant un atome d'hydrogène à la formule d'un
alcane, on obtient un groupe alkyle.Symbole : R- ou CnH2n+1-
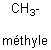
![]()
![]()
- Nomenclature
:
Quelques alcanes en formule semi-développée ou en formule topologique.
CH3-(CH2)4-
CH3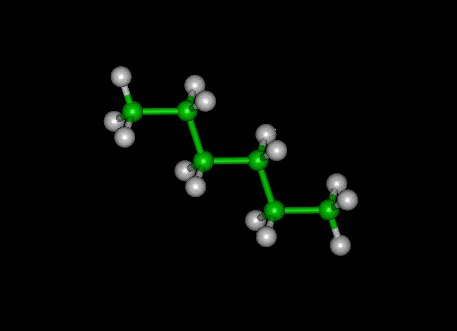
![]()
CH3-(CH2)6-
CH3
![]()
CH3-CH2-CH(CH3)-CH2-CH2-CH3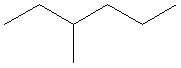
|
CH3-C(CH3)(CH3)-CH2-CH(CH3)-CH3 |
|
|
2,2,4-triméthylpentane (isooctane) |
|
CH3-CH2-CH(CH3)-CH(CH2-CH3)-CH2-CH2-CH3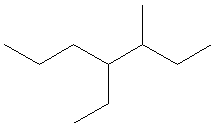
- Propriétés
physiques :
* moins denses que l'eau,
* non miscibles à l'eau,
* solvants organiques (ex : white spirit).
- Propriétés
chimiques :
* Corps stables, peu réactifs (DC-C=
350 kJ.mol-1 et DC-H= 400 kJ.mol-1)
* Combustion très exothermique
(combustibles et carburants).
Combustion complète :
CnH2n+2 + (3n+1)/2 O2![]() nCO2 +
(n+1)H2O
nCO2 +
(n+1)H2O
Combustion incomplète : flamme fuligineuse(carbone)
Combustion explosive : réactifs en proportions
stoechiométriques.
* Réactions de substitution avec
les halogènes: réactions radicalaires, photochimiques en chaînes, conduisant à
des mélanges de dérivés halogénés.
ex: en présence de lumière (U.V)

CH4+ Cl2![]() mélange de
mélange de
CH3Cl : monochlorométhane
CH2Cl2 :
dichlorométhane
CHCl3 : trichlorométhane (ou
chloroforme)
CCl4: tétrachlorométhane (ou
tétrachlorure de carbone)
Remarque:
Il s'agit d'une réaction en chaîne comportant 3
étapes:
Initiation :
Sous l'action d'UV une molécule de dichlore se scinde
en deux atomes (rupture homolytique):
![]()
Propagation:
Les deux réactions ci-dessous se produisent des
centaines de fois:
![]()
Arrêt:

Le dérivé monochloré peut à son tour participer à une
deuxième réaction de chloration...
* Pyrolyse:
(permet la valorisation du pétrole brut)
On peut provoquer:
des coupures de chaînes (molécules plus petites)
des déshydrogénations (molécules d'alcènes)
des isomérisations (molécules plus ramifiées)
des cyclisations.
Résumé des propriétés chimiques :