EXERCICE 17
Corrigé
Enoncé :
A est un composé organique, de masse
molaire 90,08 g.mol-1, formé de Carbone,
Hydrogène et Oxygène.
a) La combustion complète de 0,29276 g de
A conduit à 0,42910 g de dioxyde de carbone et
0,17566 g d'eau .
Quelle est la formule moléculaire de A?
b) Sachant que ce
composé possède un groupement hydroxyle et un groupement carboxyle sur deux
carbones voisins, donnez sa formule semi-développée et son nom.
Corrigé :
a) nCO2 =
0,42910/44 = 9,75.10-3 mole nH2O
= 0,17566/18 = 9,76.10-3 mole nA
= 0,29276/90,08 = 3,25.10-3 mole.
La formule
générale moléculaire de A est CxHyOz .
CxHyOz + α O2 → xCO2 + y/2
H2O
nA/1 = nCO2/x = nH2O/(y/2)
Soit
x = nCO2/
nA = 9,75.10-3/3,25.10-3
= 3
y = 2. nH2O/
nA = 2.9,75.10-3/3,25.10-3
= 6
La masse
molaire de A permet de trouver z :
90,08 = 16z
+ (3.12 +6.1) z = (90,08 – 42)/16
= 3
La formule
moléculaire de A est C3H6O3.
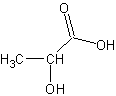
C’est
l’acide 2-hydroxypropanoïque ou acide lactique.