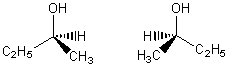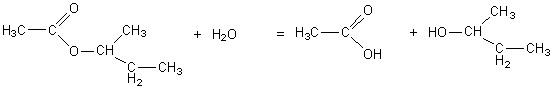EXERCICE
84
CORRIGE
RETOUR
AU SOMMAIRE
ENONCE:
L’hydrolyse
d’un ester A de formule brute C6H12O2
donne l’acide éthanoïque B et un alcool C.
1)
Sachant que l’alcool C peut présenter une activité optique,
donner la formule semi-développée et le nom de cet alcool.
Dessiner les deux énantiomères de C et préciser leur
configuration absolue.
2)
En présence d’acide sulfurique, on réalise la déshydratation
intramoléculaire de l’alcool C. il se forme deux isomères
D, composé majoritaire et D’ minoritaire.
Donner la formule plane et le nom de D et de D’.
Expliquer pourquoi D est majoritaire.
3)
Le composé D peut exister sous la forme de deux stéréoisomères.
Représenter et nommer ces deux stéréoisomères.
4)
On se propose d’oxyder l’alcool C par le permanganate de potassium en milieu
acide.
Ecrire les demi-équations électroniques et l’équation
bilan de l’oxydation de l’alcool C.
CORRIGE:
La formule générale
d’un ester est du type :

ici il a pour formule brute
: C6H12O2
son hydrolyse (cassure du squelette carboné par une molécule
d’eau H2O) conduit
à l’acide B : RCOOH et à l’alcool C : R’OH.
Sachant que l’acide B
est l’acide éthanoïque (qui demande 2 atomes de C), l’alcool
C
a pour formule moléculaire brute : C4H9OH.
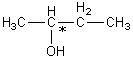
1) Si l’alcool C
présente une activité optique c’est qu’il possède
un carbone asymétrique. Un alcool à 4 carbones possédant
un carbone asymétrique ne peut être que le butan-2-ol de formule
semi-développée :
 dont
les deux énantiomères sont:
dont
les deux énantiomères sont:
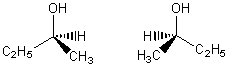
2) Déshydratation
intramoléculaire du butan-2-ol :
D : but-2-ène est
majoritaire.

D’ : but-1-ène est
minoritaire.
L’interprétation
de cette disparité dans les quantités formées est
donnée par la règle de Zaïtsev : lors de la déshydratation
d’un alcool, à chaud en présence de H2SO4,
le groupement hydroxyle OH s’élimine avec l’hydrogène voisin
porté par le carbone le plus substitué.
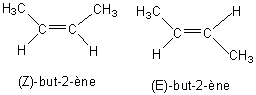
3) Les deux formes stéréoisomériques
de D sont les formes Z et E.
4) L’étude précédente
permet de donner la formule semi-développée plane de l’ester
A initial (éthanoate de 1-méthylpropyle).
R est : -CH3
et R’ est : -CH(CH3)(C2H5).
D’où l’équation bilan de réaction :
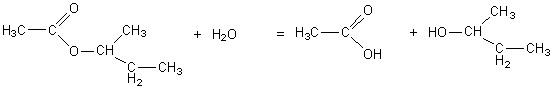
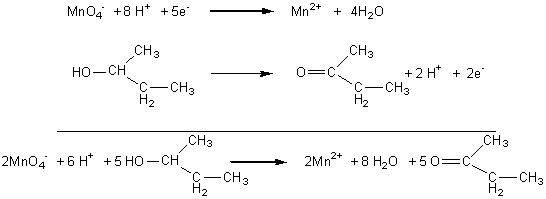
5. Oxydation de l’alcool
C par le permanganate en milieu acide : les demi-équations redox
et l’équation bilan s’écrivent :
RETOUR
A L'ENONCE
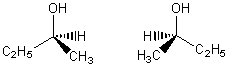
 dont
les deux énantiomères sont:
dont
les deux énantiomères sont: