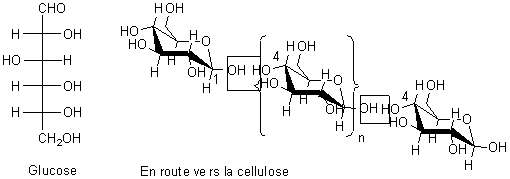EXERCICE 130
Extrait du Concours général - STLCLPI- 2008
L'acide acétique et les dérivés d'acides
Le nom de l'acide acétique dérive du mot latin "acetum"
qui désigne le vinaigre. L'acide acétique fut distillé pour la première fois à
partir du vinaigre par l'alchimiste perse Jabir Ibn Hayyan,
plus connu sous la forme latinisée de son nom Geber (721-815). On doit au
chimiste allemand Hermann Kolbe en 1847 la première synthèse de l'acide acétique
à partir d'espèces inorganiques, le dichlore et le
disulfure de carbone.
Aujourd'hui, l'acide acétique est essentiellement produit de façon synthétique, par carbonylation du méthanol. La fermentation bactérienne ne concerne plus que 10% de la production : elle demeure toutefois importante pour la fabrication du vinaigre, car dans la plupart des pays la loi stipule que le vinaigre à usage alimentaire doit être d'origine biologique. La demande mondiale d'acide acétique est d'environ 6,5 millions de tonnes par an.
Le groupe acétyle, dérivé de l'acide acétique, est fondamental pour la biochimie de pratiquement toutes les formes de vie. A la différence des acides gras, l'acide acétique n'apparaît pas dans la formation de triglycérides naturels. Il existe toutefois un triglycéride artificiel de l'acide acétique, la triacétine ou triacétate de glycéryle, qui est couramment utilisé comme additif alimentaire, dans les cosmétiques et certains médicaments.
1) De l'acide acétique à l'aspirine.
1-1) L'acide acétique : structure et effets électroniques.
1-1-1) La formule moléculaire de
l'acide acétique est C2H4O2. Indiquer sa
formule semi-développée. Indiquer son nom en nomenclature officielle.
1-1-2) Donner le schéma de Lewis de
la molécule d'acide acétique. Préciser les différents types d'atomes de carbone
et les différents types de liaison.
1-1-3) L'acide acétique (pKa environ égal à 5) est beaucoup plus acide que l'éthanol
(pKa environ égal à 16) : proposer une explication
fondée sur la stabilité relative des espèces basiques conjuguées.
1-2) L'acide
acétique : réactivité.
1-2-1) Propriétés acides : écrire
l'équation de la réaction de l'acide acétique avec l'hydroxyde de sodium en
solution aqueuse.
1-2-2) Propriétés électrophiles :
écrire l'équation de la réaction de l'acide acétique avec le glycérol
(propane-1,2,3-triol). Comment se nomme ce type de
réaction? Quelles sont ses caractéristiques?
1-2-3) Formation d'un dérivé d'acide
: écrire l'équation de la réaction de l'acide acétique avec le chlorure de thionyle (SOCl2). Comment se nomment les
produits inorganiques formés ? Quelles propriétés (parmi acide, base, oxydant,
réducteur) peuvent leur être attribuées ?
1-3) L'acide
acétique : solvant.
1-3-1) L'acide acétique est-il un
solvant : polaire, apolaire, protique, aprotique ?
1-3-2) Un exemple :
|
"Dans
un erlenmeyer rodé de 250mL parfaitement sec, peser
environ 5 gouttes d'huile. Ajouter 25 mL de dichlorométhane et 10mL de réactif de Wijs
; boucher et agiter pour homogénéiser. Laisser reposer 30 minutes à
l'obscurité (dans un placard). Le réactif de Wijs est une solution, dans l'acide acétique pur, de diiode et de trichlorure d'iode..." |
1-3-2-1) Préciser l'objectif de cette expérience.
1-3-2-2)
Ecrire l'équation de la réaction du diiode avec le
trichlorure d'iode, sachant qu'il se forme du monochlorure
d'iode.
1-3-2-3)
Indiquer comment est polarisée la liaison I-Cl dans le monochlorure
d'iode.
1-3-2-4)
Pourquoi faut-il préparer ce réactif dans l'acide acétique et non dans de l'eau
?
1-4) L'anhydride acétique.
1-4-1) Formation
1-4-1-1) Ecrire les formules de Lewis du cétène et de l'anhydride acétique.
1-4-1-2) Donner les formules de l'éthylène(ou éthène),
du méthane et du monoxyde de carbone.
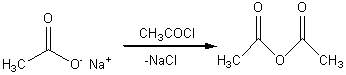
1-4-1-3) Expliquer la réaction d'acylation des ions acétate par le chlorure
d'acétyle en indiquant le rôle exercé par les ions acétate vis à vis du
chlorure d'acétyle.
1-4-2) Réactivité
1-4-2-1) Vis à vis d'un alcool :
- Ecrire
l'équation de la réaction de l'anhydride acétique avec l'éthanol.
- Préciser les
caractéristiques thermodynamiques et cinétiques de cette réaction.
- De l'éthanol
et de l'anhydride acétique, quel est le réactif nucléophile ? Le réactif
électrophile ?
1-4-2-2) Vis-à-vis de la cellulose du bois :
|
Le bois est formé pour près de la moitié de sa
masse sèche de cellulose, polymère linéaire naturel du glucose, dont la
cohésion des fibres est assuré par un liant de lignine (polymère phénolique).
Le glucose existe dans le monde vivant sous forme cyclique. La condensation de n unités monomères avec élimination d'eau conduit à la cellulose. |
La cellulose est rendue hydrophobe par réaction avec l'anhydride acétique :
- Que signifie
hydrophobe ?
- Sur quels
sites de la molécule de cellulose se produit la réaction ?
1-4-2-3) Vis-à-vis d'un phénol :
|
Le
paracétamol et l'aspirine sont fabriqués par réaction de l'anhydride acétique
avec un phénol : le 4-aminophénol pour le paracétamol, l'acide salicylique (acide 2-hydroxybenzoïque) pour l'aspirine. |
- Ecrire
l'équation de la réaction de synthèse du paracétamol.
- Ecrire
l'équation de la réaction de synthèse de l'aspirine.
- Quelle
différence peut-on relever entre les deux réactions?
- Pourquoi la
fonction amine réagit-elle mieux que la fonction phénol avec l'anhydride
acétique ?
2) Les acides gras.
2-1) Généralités
|
Les
acides gras sont des acides carboxyliques obtenus par hydrolyse des corps
gras ou triglycérides. Le nombre d'atomes de carbone de la chaîne carbonée
des acides gras est supérieur à deux. Le premier terme de la série est donc
l'acide propanoïque. |
2-1-1) Représenter la formule semi-développée de l'acide propanoïque.
2-1-2) Les acides gras qui forment les triglycérides ont, en général, des
chaînes carbonées linéaires comportant de 8 à 22 atomes de carbone, la plupart
d'entre eux en possédant 18. Ces acides gras peuvent être saturés,
mono-insaturés ou poly-insaturés.
Les
formules semi-développées de trois acides gras insaturés dont la chaîne
carbonée comporte 18 atomes de carbone sont données ci-dessous ; chaque acide
est nommé par son nom usuel, son code (entre guillemets) et son nom en
nomenclature officielle (entre crochets).
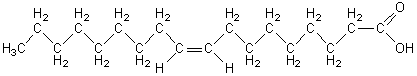
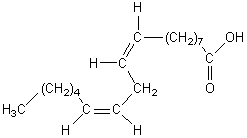
Acide oléique- "18 : 1 w 9"
[acide (Z)-octadéc-9-ènoïque]
|
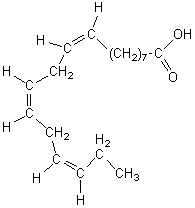
Acide linoléique- "18 : 2 w 6" [acide (9Z, 12Z)-octadéca-9,12-diènoïque] |
|
Les acides gras comportent trois
séries homologues principales : les oméga 3, les oméga
6 et les oméga 9.
Leur formule est définie par le code : "a : b w x".
2-1-2-1) Que représente la lettre "a" du code ?
2-1-2-2) Que représente la lettre "b" du code ?
2-1-2-3) Que représente la partie "w x"
du code ?
2-2) Les acides gras de l'huile de colza
|
L'huile
de colza contient 98% de triglycérides et 2% de stérols. |
2-2-1) A l'aide des formules citées plus haut, représenter le triglycéride
correspondant à l'acide gras majoritairement présent dans l'huile de colza.
2-2-2)
Ecrire l'équation de transestérification de ce
triglycéride.
2-2-3)
Préciser le type de catalyseur utilisé dans cette réaction, par analogie avec
l'estérification.
3) Quelques acides naturels
importants
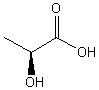
3-1) L'acide lactique
Dans la littérature l'acide lactique est représenté ainsi :
3-1-1) Donner la
formule semi-développée plane de cet acide.
3-1-2)
Indiquer son nom en nomenclature officielle.
3-1-3)
L'acide lactique de configuration S est représenté ci-dessus dans l'espace.
3-1-3-1) Cette molécule est-elle chirale ? Pourquoi ?
3-1-3-2) Peut-elle avoir une action sur la lumière polarisée ?
3-1-3-3) Dessiner la représentation de Cram des
différents stéréoisomères de l'acide lactique.
Préciser dans chaque cas la configuration de la molécule représentée.
3-2) L'acide tartrique
Le nom officiel de l'acide tartrique est l'acide 2,3-dihydroxybutanedioïque.
3-2-1)
Préciser la formule semi-développée plane de ce diacide.
3-2-2) Quel
nombre maximum de stéréoisomères peut-il avoir ?
Pourquoi ?
3-2-3)
Dessiner la représentation de CRAM de l'acide tartrique 2(R), 3(S). Ce stéréoisomère est-il chiral ? Pourquoi ?
4) Un polymère dérivé d'acide
: le polyméthacrylate de méthyle.
|
C'est
le plus important des polymères dérivés de l'acide acrylique (de formule
semi-développée CH2=CH-COOH), produit à l'échelle industrielle
depuis le début de la deuxième guerre mondiale. Il s'agit d'un matériau
rigide, transparent, doté d'une capacité exceptionnelle de transmission de la
lumière, supérieure à celle des verres inorganiques. |
4-1) Donner le
sigle utilisé pour désigner le polyméthacrylate de
méthyle.
4-2) Quelle propriété de ce polymère est à la base de sa
principale application dans le bâtiment ? Quelle est cette application ?
4-3) Ce polymère est-il obtenu par polyaddition ou par
polycondensation ?
4-4) Ecrire l'équation de la réaction du méthanol avec
l'acide acrylique.
4-5) De quel type de réaction s'agit-il ?
4-6) Quel est le nom du produit obtenu ? Quelle fonction ce
produit porte-t-il ?
4-7) Cette réaction possède-t-elle un rendement satisfaisant
pour une utilisation industrielle ? Expliquer.
4-8) Comment peut-on procéder au laboratoire pour augmenter
ce rendement ? Indiquer deux méthodes.
4-9) Les résines acryliques ont pour formule générale : (CH2-CXY)n avec : X = CxH2x+1
(x = 0 ou 1) et Y = COO-CyH2y+1
ou CONH2 ou CN.
On veut déterminer la formule semi-développée d'une résine acrylique ne
possédant pas de caractère acide et qui renferme 32% d'oxygène et 0% d'azote
(en masse).
4-9-1) Quelles possibilités peut-on
éliminer pour le groupement Y ?
4-9-2) Indiquer la formule brute de
cette résine en fonction de x et y ?
4-9-3) Exprimer sa masse molaire en
fonction de x, y, et n.
4-9-4) Calculer la somme x+y.
4-9-5) Quelles qsont
les valeurs possibles pour x et y ?
4-9-6) Indiquer la ou les formule(s)
semi-développée(s) possible(s) pour cette résine.
Données : Masses molaire atomiques (en g.mol-1)
C : 12,0 H : 1,0 O :
16,0 N : 14,0