EXERCICE 179
Étude de deux voies de
synthèse de la trichostatine A
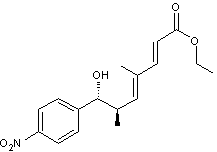
La (+)-trichostatine A, représentée
ci-dessus, est un antibiotique aux propriétés antifongiques, connu dès 1976. En
1987, son aptitude à empêcher la prolifération de certaines cellules
cancéreuses est également mise en évidence. Afin d’être utilisée à des fins
thérapeutiques, une voie de synthèse de cette molécule avec un rendement et une
pureté suffisantes doit pouvoir être proposée. Dans ce sujet, deux voies de
synthèse seront étudiées.
Remarques :
·
Le candidat trouvera en annexe
une table des nombres d’onde des vibrations d’élongation et de déformation en
spectroscopie infrarouge ainsi les domaines de déplacement chimique des protons
en spectroscopie RMN.
·
Abréviations
utilisées dans le texte :
rdt rendement
T°amb température ambiante
DMF diméthylformamide
THF tétrahydrofurane
·
Les
trois parties sont indépendantes.
Partie 1 : la molécule de
trichostatine
1) Quel qualificatif est utilisé
pour désigner une molécule dont le nom est précédé par le symbole (+), comme la
(+)-trichostatine A ?
Que signifie ce qualificatif ?
2) Indiquer en
justifiant succinctement par l’utilisation des règles de Cahn, Ingold et Prelog
la configuration absolue de l’atome de carbone asymétrique numéroté 1 de la trichostatine A.
3) Indiquer la stéréochimie de
la double liaison entre les atomes de carbone numérotés ci-dessus 2 et 3 en
justifiant brièvement la réponse.
Partie 2 : étude d’une première voie de synthèse
On indique que le dioxyde de manganèse MnO2 utilisé dans
cette synthèse est un agent oxydant sélectif
des alcools allyliques, c’est-à-dire
porté par le carbone en α d’une double liaison carbone-carbone. Ce réactif permet d’oxyder les
alcools allyliques primaires en aldéhyde.
![]()
Alcool allylique
Mode opératoire :
·
On réalise une réaction
d’aldolisation entre le 4‑nitrobenzaldéhyde B (commercial, ≈ 60 € les 100 g) et un excès
de propanal dans le DMF (5 h, 0 °C), en présence d’un catalyseur.
Structure de B :
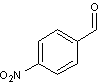
·
Le composé C obtenu est ensuite traité par
1,2 équivalent du réactif R1,
préparé in situ et représenté ci-contre, et agité dans le dichlorométhane
pendant 5 h. On obtient le composé D
de formule brute C14H17NO5 avec un
rendement de 93 % à partir de B.
Structure de R1 :
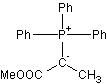
·
D est réduit par le tétrahydruroborate de lithium LiBH4
(réactivité similaire à celle de LiAlH4) dans un mélange de THF et
de toluène (1 h, -70 °C), on obtient ainsi le composé E, ensuite oxydé en F
par le dioxyde de manganèse dans le dichlorométhane (1 h, T°amb). Le composé F est obtenu avec un rendement
de 80 % à partir de D.
·
Le composé F est transformé en G, dont on indique la formule
dans l’annexe 1, par la réaction de Wittig-Horner, analogue à la réaction de
Wittig. On utilise pour ce faire le phosphonate R2 ci-contre et de l’hydrure de sodium NaH. Le tout est
agité dans le THF à température ambiante pendant 1 h, le rendement de cette
étape est de 96 %.
Structure de R2 :
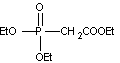
·
En présence d’un catalyseur
(palladium déposé sur sulfate de baryum et désactivé par empoisonnement à la
quinoléine), à température ambiante et sous atmosphère de dihydrogène, G est transformé en H avec un rendement de
62 %. Le spectre infrarouge de H
présente entre autres deux pics intenses vers 3400 cm-1.
·
H est transformé en trichostatine
A en trois étapes avec un rendement de 39 %.
Questions relatives
à la séquence réactionnelle :
4) À l’aide du mode opératoire
fourni ci-dessus, donner les formules des molécules manquantes dans l’annexe 1, sans tenir compte de la
stéréochimie.
5-1) Quel catalyseur est utilisé usuellement pour réaliser une réaction
d’aldolisation, comme celle ayant lieu lors de la transformation B à C ?
5-2) Donner alors le mécanisme de
la réaction entre B et le
propanal, en utilisant le catalyseur proposé à la question 5-1)
5-3) Combien la molécule C présente-t-elle a priori de stéréoisomères ? Indiquer
le raisonnement suivi.
On admettra dans la suite du sujet que grâce à
l’utilisation dans cette étape d’un catalyseur énantiosélectif, un seul
stéréoisomère est obtenu.
6-1) Comment appelle-t-on un réactif tel que R1 ?
6-2) Quel est le nom de la réaction de formation de D ?
7) Quels seraient les
changements observés en spectroscopie infrarouge lors de la transformation C à D ? On justifiera en indiquant
précisément la nature et le nombre d’onde des bandes de vibration dont
l’absence ou la présence serait significative.
8) Proposer un mécanisme
réactionnel pour la séquence F
à G. On prendra soin de préciser à l’aide de l’écriture de ce
mécanisme le rôle de l’hydrure de sodium.
9) À quelle(s) vibration(s) sont
dus les deux pics vers 3 400 cm-1 observés sur le spectre
infrarouge de H ?
10) Pourquoi a-t-on utilisé du
palladium désactivé lors de la transformation G à H ?
Autour de cette
première voie de synthèse
11) Calculer le rendement global
de cette synthèse multi-étapes dont on précisera le nombre d’étapes.
Partie 3 : étude d’une deuxième voie de synthèse.
Cette deuxième voie de
synthèse permet d’obtenir la trichostatine
A à partir du réactif commercial noté K, le (R)-3-hydroxy-2-méthylpropanoate
de méthyle (≈ 30 € le gramme).
On précise que l’abréviation
TBDMS-Cl désigne le chlorure de tert-butyldiméthylsilyle qui permet de protéger
la fonction alcool de K sous
forme d’éther silylé. La fonction alcool est régénérée par le réactif TBA-F, ou
fluorure de tétra-n-butylammonium,dans
l’étape P à Q.
Synthèse de
l’intermédiaire Q
Le schéma de synthèse de
l’intermédiaire Q est fourni
ci-dessous :
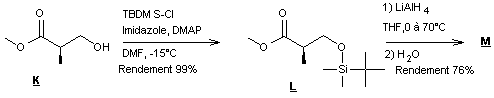
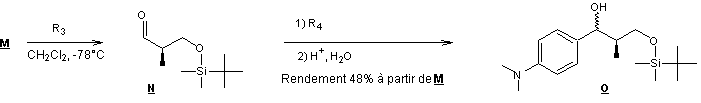
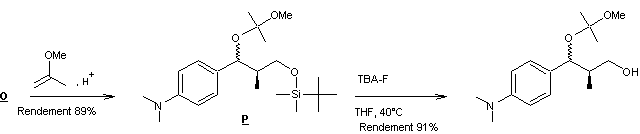
Le dernier composé formé étant
le composé Q .
12) On fournit en annexe 2, les caractéristiques du
spectre de RMN du proton de la molécule L.
Compléter le tableau de cette annexe en utilisant la numérotation des groupes
de protons indiquée.
13-1) Donner la
structure du produit M.
13-2) Indiquer, à
l’aide des adjectifs suivants, les caractéristiques requises par le solvant
lors de la transformation L à M : protique,
apolaire, aprotique, polaire.
14) Quel type de
transformation est effectué pour passer de M
à N ? Indiquer un
réactif R3 susceptible de
convenir pour cette transformation.
15-1) La transformation
de N à O est réalisée à l’aide d’un organomagnésien mixte. Indiquer
la structure du magnésien R4
à choisir.
15-2) Donner le schéma
réactionnel de formation de O
à partir de ce réactif.
16-1) Au cours de la transformation O à P, un intermédiaire réactionnel
est formé par réaction entre l’alcène utilisé et les ions H+.
Indiquer la structure de cet intermédiaire et son mécanisme de formation, en
justifiant la régiosélectivité observée.
Proposer alors un mécanisme réactionnel pour la transformation O à P.
16-2-1) Lors de la
synthèse de P, la phase
organique est lavée avec une solution d’hydrogénocarbonate de sodium, puis avec
de l’eau distillée. Justifier la nécessité de chacun de ces lavages.
16-2-2) Comment vérifier l’efficacité
du lavage à l’hydrogénocarbonate de sodium ?
17) Indiquer une
étape, en argumentant clairement votre réponse, qui justifie la protection de
la fonction alcool de K.
Obtention de la
trichostatine A
Par une séquence proche de
celle de la première voie de synthèse (partie 2) utilisant notamment
successivement deux réactions de Wittig, on obtient le composé R.
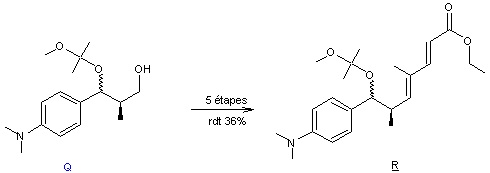
La trichostatine A est ensuite obtenue comme suit à partir de R
avec un rendement de 57% :
![]()
18) Indiquer le nom
de la transformation ayant lieu lors de l’étape R à S et donner la structure du
composé S.
Autour de cette deuxième voie de synthèse
19) Calculer le rendement global
de cette synthèse multi-étapes dont on précisera le nombre d’étapes.
Conclusion générale
20) En tant qu’expérimentateur,
laquelle de ces deux voies de synthèse choisiriez-vous d’utiliser ? Étayer
la réponse par au moins deux arguments.
Annexe 1 (à
rendre avec la copie)
Feuille de résultats de la partie 1
|
B
|
C |
|
D |
E |
|
F |
G
|
|
H
|
trichostatine
A
|
Annexe 2 (à
rendre avec la copie)
Données
relatives au spectre de RMN du proton de la molécule L dont la structure
est rappelée ci-dessous :
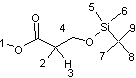
|
Déplacement chimique δ (ppm) |
Multiplicité du signal |
Intégration (en nombre de proton(s)) |
Identification des protons du signal |
Identification des protons voisins |
|
3,70 |
doublet |
2 |
|
|
|
3,07 |
singulet |
3 |
|
|
|
2,67 |
multiplet |
1 |
|
|
|
1,15 |
doublet |
3 |
|
|
|
0,90 |
singulet |
9 |
|
|
|
0,08 |
singulet |
6 |
|
|
SPECTROSCOPIE INFRAROUGE
Table
des nombres d’onde des vibrations d'élongation et de déformation
Ctet : C tétragonal Ctri : C
trigonal >C= Cdi : C digonal -Cº
|
Liaison |
Nature |
Nombre d’onde
(cm-1) |
Intensité F : fort ; m : moyen ; f :
faible |
|
O-H alcool libre |
Elongation |
3590-3650 |
F
(fine) |
|
O-H alcool lié |
Élongation |
3200-3600 |
F (large) |
|
N-H amine |
Élongation |
3300-3500 |
M (deux bandes si primaire) |
|
N-H amide |
Élongation |
3100-3500 |
F |
|
Cdi-H |
Élongation |
~ 3300 |
M ou f |
|
Ctri-H |
Élongation |
3030-3100 |
M |
|
Ctri-H aromatique |
Élongation |
3000-3100 |
M |
|
Ctet-H |
Élongation |
2850-2970 |
F |
|
Ctri-H aldéhyde |
Élongation |
2700-2900 |
M ; 2 bandes |
|
O-H acide carboxylique |
Élongation |
2500-3200 |
F à m (large) |
|
CºC |
Élongation |
2100-2260 |
F |
|
CºN nitriles |
Élongation |
2200-2260 |
F ou m |
|
C=O anhydride |
Élongation |
1800-1850 1740-1790 |
F |
|
C=O chlorure d’acide |
Élongation |
1790-1815 |
F |
|
C=O ester |
Élongation |
1735-1750 |
F |
|
C=O aldéhyde et cétone |
Élongation |
1700-1740 abaissement de ~ 20 à 30 cm-1
si conjugaison |
F |
|
C=O acide carboxylique |
Élongation |
1700-1725 |
F |
|
C=O amide |
Élongation |
1650-1700 |
F |
|
C=C |
Élongation |
1620-1690 |
M |
|
C=C aromatique |
Élongation |
1450-1600 |
Variable ; 3 ou 4 bandes |
|
N=O (de –NO2) Conjugué |
Élongation |
1500-1550 1290-1360 |
F |
|
N=N |
Élongation |
1400-1500 |
f ; parfois invisible |
|
C=N |
Élongation |
1640-1690 |
F ou m |
|
N-H amine ou amide |
Déformation |
1560-1640 |
F ou m |
|
Ctet-H |
Déformation |
1430-1470 |
F |
|
Ctet-H (CH3) |
Déformation |
1370-1390 |
F ; 2 bandes |
|
O-H |
Déformation |
1260-1410 |
F |
|
P=O |
Élongation |
1250-1310 |
F |
|
Ctet-O-Ctet (étheroxydes) |
Elongation |
1070-1150 |
F |
|
Ctet-OH (alcools) |
Élongation |
1010-1200 |
|
|
Ctet-O-Ctri (esters) Ctri-O-Ctri (anhydrides) |
Élongation |
1050-1300 |
F ; 1 ou 2 bandes |
|
C-N |
Élongation |
1020-1220 |
M |
|
C-C |
Élongation |
1000-1250 |
F |
|
C-F |
Élongation |
1000-1040 |
F |
|
Ctri-H de -HC=CH- (E) (Z) |
Déformation Déformation |
960-970 670-730 |
F M |
|
Ctri-H aromatique monosubstitué |
Déformation |
730-770 et 680-720 |
F ; 2 bandes |
|
Ctri-H aromatique o-disubstitué m-disubstitué p-disubstitué |
Déformation Déformation Déformation |
735-770 750-800 et 680-720 800-860 |
F F et m ; 2 bandes F |
|
Ctri-H aromatique 1,2,3 trisubstitué 1,2,4 trisubstitué 1,3,5 trisubstitué |
Déformation Déformation Déformation |
770-800 et 685-720 860-900 et 800-860 810-865 et 675-730 |
F et m ; 2 bandes F et m ; 2 bandes F et m ; 2 bandes |
|
Ctet-Cl |
Élongation |
600-800 |
F |
|
Ctet-Br |
Élongation |
500-750 |
F |
|
Ctet-I |
Élongation |
» 500 |
F |
SPECTROSCOPIE DE RMN DU PROTON
Domaines de déplacements chimiques des protons des groupes M (méthyle CH3,
méthylène CH2 et méthyne CH) en a ou en b de groupes
caractéristiques.
|
type de proton |
d en ppm |
type de proton |
d en ppm |
|
CH3-SiR3 M‑CH2R M‑C=C M‑CºC M‑Ph M‑F M‑Cl M‑Br M‑I M‑OH et M‑OR M‑OPh M‑O‑CO‑R M‑O‑CO‑Ph M‑CHO et M‑CO‑R M‑CO‑Ph M‑CO‑OH et M‑CO‑OR M‑CO‑NR2 M‑CºN M‑NH2 et M‑NR2 M‑N+R3 M‑NH‑CO‑R M‑NO2 M‑SH et M‑SR |
0,0-1,0 0,8-1,6 1,6-2,0 1,7-2,8 2,2-2,8 4,2-4,8 3,0-4,0 3,4-4,1 3,1-4,2 3,2-3,6 3,8-4,6 3,6-5,0 3,8-5,0 2,1-2,6 3,8-5,0 1,8-2,6 1,8-2,2 2,2-3,0 2,2-3,0 3,0-3,6 3,0-3,8 4,1-4,4 2,1-5,1 |
M‑C‑CH2R M‑C‑C=C M‑C‑CºC M‑C‑Ph M‑C‑F M‑C‑Cl M‑C‑Br M‑C‑I M‑C‑OH et M‑C‑OR M‑C‑OPh M‑C‑O‑CO‑R M‑C‑O‑CO‑Ph M‑C‑CHO M‑C‑CO‑R M‑C‑CO‑Ph M‑C‑CO‑OR M‑C‑CO‑NR2 M‑C‑CºN M‑C‑N+R3 M‑C‑NH‑CO‑R M‑C‑NO2 M‑C‑SH
et M‑C‑SR |
0,9-1,6 1,0-1,8 1,2-1,8 1,1-1,8 1,5-2,2 1,5-2,0 1,8-1,9 1,7-2,1 1,2-1,8 1,3-2,0 1,3-1,8 1,6-2,0 1,1-1,7 1,1-1,8 1,1-1,9 1,1-1,9 1,1-1,8 1,2-2,0 1,4-2,0 1,1-1,9 1,6-2,5 1,3-1,9 |
Domaines
de déplacements chimiques de divers protons
|
type de proton |
d / ppm |
type de proton |
d / ppm |
|
>C(cycle)=CH2 >C=CH2 ‑C=CH‑ ‑C=CH‑ (cyclique) R‑CºC‑H Ar‑H >C=CH‑CO‑ ‑CH=C‑CO‑ R‑CHO Ar‑CHO H‑CO‑O‑ H‑CO‑N< |
4,6 5,3 5,1 5,3 3,1 7,0-9,0 5,9 6,8 9,9 9,9 8,0 8,0 |
‑CO‑OH >C=C‑OH PhH R‑OH Ar‑OH Ar‑OH (avec liaison H intramoléculaire) R‑NH‑ Ar‑NH R‑CO‑NH‑ CHCl3 H2O |
8,5-13 11-17 7,2 0,5-5,5 4,0-7,5 5,5-12,5 0,5-3,0 3,0-5,0 5,0-8,5 7,2 »5,0 |