EXERCICE 102
Corrigé
Enoncé
Interprétation
des étapes de la diazotation de l’aniline.
Les réactifs et auxiliaires :
- l’aniline C6H5NH2 peu
soluble dans l’eau ; C6H5NH3+ / C6H5NH2
pKa = 4,58
- le nitrite de sodium NaNO2
; HNO2 / NO2- pKa =
3,3 E0(HNO2 /
NO) = 1,00V E0(NO3- / HNO2) = 0,94V
- l’acide chlorhydrique concentré ;
- le papier ioduro-amidonné
(papier imprégné d’ions iodure et d’empois d’amidon) vire au bleu en présence de diiode. E0(I2 /
I-) = 0,54V.
Les grandes étapes de cette transformation peuvent
être schématisées de la façon suivante :
a) mise en solution aqueuse de
l’aniline ;
b) réaction de diazotation.
Dans
la première phase de cette manipulation on mélange : l’aniline, l’eau
puis l’acide chlorhydrique concentré.
1) Ecrire l’équation de réaction globale
modélisant la transformation, et l’interpréter.
Après
refroidissement du milieu réactionnel (0°C<q<5°C)
on ajoute une solution aqueuse de nitrite de sodium.
2) Ecrire les équations de réactions :
- de mise en solution du
nitrite de sodium dans l’eau ;
- de sa transformation avec la
solution aqueuse d’acide chlorhydrique. Interpréter.
- De la réaction dite de diazotation.
Après
cette addition on laisse le milieu réactionnel évoluer cinq minutes et on
réalise un test au papier ioduro-amidonné. Une goutte
du mélange réactionnel est déposée sur le papier qui doit bleuir
instantanément.
3) Ecrire les équations de réactions permettant d’interpréter
le bleuissement du papier ioduro-amidonné.
4) Que traduit l’absence de bleuissement ?
Quel est alors le réactif limitant de la transformation de diazotation
? Que peut-on faire pour faire réagir toutes les molécules d’aniline
présentes dans la solution?
Corrigé
1) Mise en solution aqueuse.
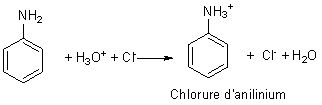
Il s’agit d’une réaction acido basique entre les ions oxonium H3O+ et la base C6H5NH2. Le sel formé composé à caractère ionique est soluble dans l’eau alors que l’aniline l’est peu. Dans la poursuite de la transformation l’ion anilinium en solution aqueuse ne formera qu’une seule phase avec les autres réactifs.
2) Les équations de réactions
:
- mise en solution aqueuse du nitrite de sodium :
![]()
- transformation avec la solution aqueuse d’acide
chlorhydrique :
![]()
Il s’agit d’une réaction acido
basique entre l’ion NO2-
base du couple HNO2 / NO2- et l’ion oxonium pour
former l’acide nitreux dans le milieu réactionnel.
- Réaction de diazotation :
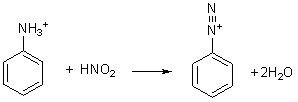
3) Interprétation du bleuissement
du papier ioduro-amidonné :
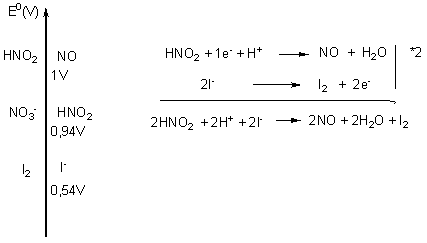
Parmi les couples proposés, le couple susceptible de réagir avec les ions
iodure est le couple HNO2 / NO.
Ainsi l’oxydant le plus fort HNO2
réagit avec le réducteur le plus fort I- . Il se forme alors du diiode qui en présence d’amidon vire au bleu.
Pour cela il faut que la goutte prélevée dans le milieu réactionnel contienne de
l’acide nitreux HNO2 n’ayant
pas réagi, donc en excès.
4) L’absence de bleuissement traduit un défaut d’acide nitreux, qui
est alors le réactif limitant de la réaction de diazotation.
Pour consommer toute l’aniline initialement introduite il faut ajouter du
nitrite de sodium pour former une nouvelle quantité d’acide nitreux.