QUESTIONNAIRE 85
Exercice
1
1) Donner le nom de la molécule suivante:
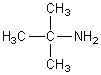
2) Donner la formule des molécules suivantes:
- Hexan-3-amine
- Propane-1,3-diamine
- Butane-1,2,4-triamine
Exercice
2
Un composé oganique A a 53,33% de carbone 15,56% d'hydrogène et 31,11%
d'azote. Sa densité de vapeur est d = 1,552.
1) Déterminer sa formule brute.
2) Donner pour l'ensemble des isomères correspondant à cette formule brute, la
formule semi-développée ainsi que le nom et la classe.
3) On dissout une masse m de A dans 1L d'eau. A une prise d'essai de 10mL de
cette solution on ajoute progressivement de l'acide chlorhydrique de
concentration 0,15 mol.L-1 placé dans une burette, en
présence d'un indicateur coloré: le rouge de méthyle. Il faut verser 6,67 mL d'acide pour voir virer l'indicateur.
3-1) Le composé A est une amine primaire. Ecrire l'équation
de réaction de l'acide chlorhydrique sur A.
3-2) Calculer la concentration de la solution d'amine.
3-3) Quelle est la masse m d'amine qu'il a fallu peser pour
préparer le litre de solution?
4) On fait réagir cette amine A sur une solution de sulfate de cuivre.
4-1) Ecrire l'équation de la réaction quand l'amine n'est
pas en excès.
4-2) Que se passe-t-il si l'on ajoute A en excès? Quelle est
la formule de l'ion complexe qui se forme?
Rappel: La masse molaire d'un gaz ou d'une vapeur de densité d, s'obtient par la formule: M = 29d.