SPECTROMETRIE
D’ABSORPTION
1) Généralités:
La spectrométrie
d'absorption (IR,UV, visible) utilise les interactions
entre la matière et un rayonnement électromagnétique, qui nous conduit à des
renseignements :
- qualitatifs: groupements fonctionnels présents dans
une molécule (IR) ou,
- quantitatifs: concentration en molécules ou ions, d'une
solution (UV,visible).
2) Rayonnement électromagnétique: aspect ondulatoire
- On peut considérer qu'il s'agit d'une onde
sinusoïdale qui se propage tout autour d'une source avec une vitesse
(ou célérité) c de 300 000 km/s dans le vide ou dans l'air (bien qu'elle
soit alors légèrement plus faible), moindre dans tous les autres milieux
transparents.
- Cette onde possède une période
temporelle T (s) qui est la durée au bout de laquelle en un point
donné de l'espace, elle se reproduit identique à elle-même.
- La fréquence ,qui est l'inverse de la période, n(Hz) = 1/T(s),
correspond au nombre de fois que l'onde se reproduit identique à elle-même,
par seconde, en un point donné de l'espace.
- T et n, sont
caractéristiques de la source qui produit l'onde
électromagnétique.
- L'onde possède aussi une période
spatiale, qui est la distance (en m) qui sépare 2 points de l'espace
successifs qui sont dans le même état vibratoire.C'est
aussi la distance parcourue par l'onde en T secondes; on l'appelle
longueur d'onde et on la désigne par
l. Cette longueur
d'onde dépend de la source et du milieu dans lequel l'onde se propage.
|
l= c.T = c/n |
- Le domaine des radiations
électromagnétiques est trés vaste; on pourrait
le classer par ordre de fréquences des sources qui les émettent; on les
présente souvent par ordre de l croissantes (dans le vide):
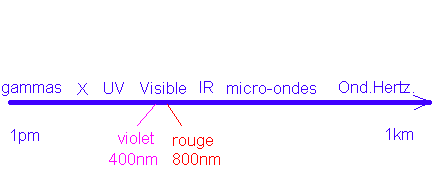
- Suivant la fréquence d'une source l'oeil perçoit des couleurs différentes (spectre
visible); on appelle lumière monochromatique une onde
correspondant à une fréquence donnée de la source donc à une longueur
d'onde donnée dans le vide (une couleur donnée).
- Une source peut-être polychromatique
et possède donc plusieurs fréquences de vibration; la couleur qui en
résulte est la superposition des couleurs des lumières monochromatiques
qui la composent. La lumière blanche est la superposition de l'ensemble
des radiations du domaine du visible.
3) Rayonnement
électromagnétique: aspect énergétique
- Un rayonnement monochromatique, transporte
une quantité d'énergie sous forme de "grains d'énergie" (sans
masse) appelés photons; la valeur de l'énergie que transporte
chaque photon ne dépend que de la fréquence de l'onde qui l'accompagne:
|
E = h.n avec E en joules(J) et n en Hz
E = h.c/l avec E (J), c(m.s-1), l(m) |
- h est une constante appelée constante de
Planck et vaut h = 6.626.10-34J.s
Application numérique: Calculez l'énergie d'un photon "rouge" (l = 800nm) et d'un photon
"violet" (l = 400nm); comparez.
* rouge : Er = 6.626.10-34 x 3.108/ 800.10-9= 2,48.10-19 J
* violet : Ev = 6.626.10-34 x 3.108/ 400.10-9= 4,96.10-19 J
On voit que Ev > Er
4) Spectrométrie
d'absorption :
lorsqu'un milieu (composé d'atomes, de molécules ou d'ions) est traversé
par un rayonnement électromagnétique, il se produit des interactions entre le
milieu et le rayonnement qui se traduisent par des modifications énergétiques
du milieu et du rayonnement.
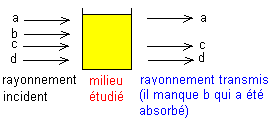
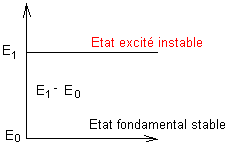
En absorbant des photons accompagnant une onde telle que l= c/n, le milieu est passé
d'un état d'énergie E0 (état fondamental) à un état d'énergie E1 tel que E1-E0 = h.n; l'état d'énergie E1, supérieure à E0 est dit état excité;
il est moins stable que l'état fondamental.
Remarque 1:
Un milieu donné, n'existe pas dans n'importe quel état énergétique. Il n'existe
que dans quelques états bien définis d'énergie E0,E1,E2... On dit que ses états d'énergie sont quantifiés. Il en découle
qu'il ne pourra absorber n'importe quel photon, mais ceux dont l'énergie h.n, correspondra
exactement au passage d'un état donné vers un autre état donné, d'énergie
supérieure.
Application:
L'éthanol sous forme de vapeurs, absorbe des photons dont l'énergie est de
0,447 eV (électron-volt...1eV = 1,6.10-19 J). Déterminez la longueur d'onde, dans le vide, du rayonnement
qui transporte ces photons. A quel domaine du spectre appartient-il?
DE = 0,447 eV = 0,447x 1,6.10-19= 7,152.10-20J
DE = h.n = h.c/l soit l = h.c/
DE
l= 6,626.10-34 x 3.108 / 7,152.10-20= 2,78.10-6 m
soit l = 2780 nm . Nous sommes
dans le domaine des IR (infra-rouge).
Remarque 2:
suivant les domaines d'énergie auxquels on s'adresse, on peut distinguer :
- les énergies électroniques: E1-E0 est élevé; on travaille dans l'U.V. ou le visible:
ce sont les énergies des électrons des atomes, constituant les molécules, ou
les énergies des liaisons entre les atomes qui ont été modifiées.Ces
énergies sont quantifiées.
- les énergies de vibration des atomes: E1-E0 est moins élevée, on est dans le domaine de
l'IR. Ce sont les vibrations des atomes dans la molécule qui ont été modifiées.Ces énergies sont quantifiées.
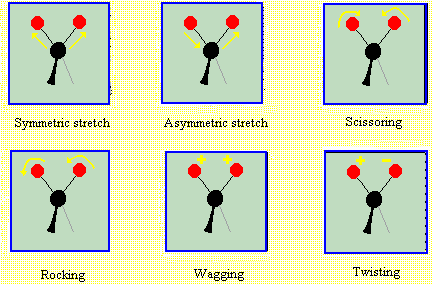
- les énergies de rotation des atomes: E1-E0 est moins encore moins élevée, on est dans l'IR
plus lointain. Ces énergies sont quantifiées.
- les énergies de translation des molécules: E1-E0 est moins encore plus petite. Ces énergies
ne sont pas quantifiées. N'importe quel photon est susceptible de modifier
l'énergie de translation d'une molécule.
Remarque:
Seules les énergies quantifiées sont intéressantes en spectrométrie. L'étude du
rayonnement transmis comparé au rayonnement incident, permet de connaître les
énergies qui ont été fournies au milieu et par là, la structure de celui-ci.