Les propriétés chimiques des atomes dépendent des électrons qu'ils contiennent, tout particulièrement de ceux situés sur la couche externe.
Structure électronique d'un atome :
Un atome possède Z électrons (Z = le n°atomique), répartis en couches (niveaux d'énergie), notées 1,2,3... ou K,L,M...
Chaque couche peut contenir un nombre maximum de 2n² électrons (n=n° de la couche), soit 2 pour la première, 8 pour la seconde, etc... Les couches sont elles mêmes divisées en plusieurs sous-couches.
Voici quelques exemples de formules électroniques d'atomes :
|
H |
He |
C |
N |
O |
Ne |
Cl |
|
(K)1 |
(K)2 |
(K)2(L)5 |
(K)2(K)6 |
(K)2(L)8 |
(K)2(L)8(M)7 |
Représentation de Lewis
d'un atome :
Elle donne une représentation des atomes, sous forme de doublets électroniques | ou d'électrons célibataires.

Règle de l'octet
Les atomes tendent à acquérir la structure électronique d'un gaz rare (car ceux-ci ont une grande stabilité chimique : He, Ne, Ar...)
Cela peut être réalisé de plusieurs façons :
- gain d'un ou plusieurs électrons (formation
d'un ion négatif monoatomique ex Cl-)
- perte d'un ou plusieurs électrons
(formation d'un ion positif monoatomique ex Na+)
- établissement de liaisons de covalence
conduisant soit
- à des molécules par exemple NH3
- à des ions polyatomiques par exemple NO3-
Voici la structure de
Lewis des ions O2- et Cl- :

C'est bien la structure d'un gaz rare (couche externe saturée)
La liaison de covalence
Quand deux atomes s'unissent par une liaison de covalence, chacun apporte un électron, et les deux électrons sont "mis en commun" entre les deux atomes. Par ce mécanisme, tout se passe comme si chaque atome avait un électron de plus sur sa couche externe.
Ce mécanisme se répète jusqu'à ce l'atome acquière la structure électronique d'un gaz rare ; cela explique que :
- l'hydrogène H établisse 1 liaison (il est
monovalent)
- de même pour le chlore Cl ou l'iode I
- l'oxygène O est divalent
- l'azote N est trivalent
- le carbone C est tétravalent
Voici la représentation
de Lewis de quelques molécules :
- Le dihydrogène, avec un doublet liant entre
les deux atomes :
![]()
- Le chlorure d'hydrogène :
![]()
- La molécule d'eau, dans laquelle l'atome
d'oxygène est entouré de deux doublets liants et de deux doublets non
liants :
![]()
- La molécule d'ammoniac, avec l'atome
d'azote trivalentet porteur également d'un doublet d'électrons libres :
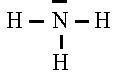
- La molécule de méthane, dans laquelle on
voit bien le carbone tétravalent :
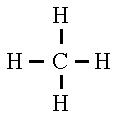
Tous les atomes
précédents sont entourés de 4 paires d'électrons, sauf l'hydrogène qui n'a
besoin que de 2 électrons pour avoir la structure de l'hélium, gaz rare qui le
suit dans la classification périodique.
Insuffisance du modèle de Lewis
Le modèle de Lewis n'est pas suffisant pour prévoir la forme des molécules, qui est pourtant reliée à la structure électronique des atomes.
(Valence Shell Electron Pair Repulsion, c'est à dire : répulsion des paires d'électrons de la couche de valence, théorie due à Ronald Gillespie)
Principe de la méthode :
On s'occupe de la forme de la molécule autour d'un atome donné
On compte le nombre de directions de l'espace contenant soit des
doublets liants, soit des doublets non liants ; la forme de la molécule, autour
de l'atome considéré, est la plus symétrique qui soit, en fonction de ce
nombre.
Il y a alors trois cas :
- deux directions de liaisons seulement : la
molécule est linéaire
- trois directions : la molécule est plane,
triangulaire
- quatre directions : la forme de base est tétraédrique
Exemples de molécules ou
d'ions polyatomiques :
Les différents types de molécules sont notés
|
AXnEm |
- A représente l'atome central
- X représente les directions, au nombre de
n, comportant des doublets de liaison
- E représente les directions, au nombre de
m, comportant des doublets non liants
- n+m représente donc le nombre total de
directions à prendre en compte, et détermine la forme de base de la
molécule autour de A.
1er cas n+m=4 : la forme dérive d'un tétraèdre
- AX4:molécules de méthane, éthane... d'une
façon générale, autour d'un carbone où il n'y a que des simples liaisons,
mais également l'ion ammonium : la forme est alors tétraédrique.
- AX3E: molécule d'ammoniac, de méthanamine,
d'éthanamide, d'une façon générale, autour d'un azote où il n'y a que des
simples liaisons, mais également ion hydronium... : la forme est alors
celle d'une pyramide à base triangulaire.
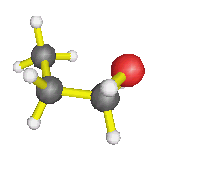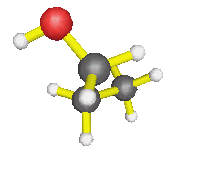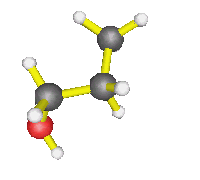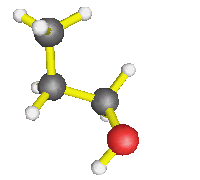
- AX2E2 : molécule d'eau, d'une façon générale,
autour d'un oxygène où il n'y a que des simples liaisons (dans l'éthanol
par exemple) : la molécule est coudée.
2ème cas n+m=3
- AX3
la molécule est plane, triangulaire, avec des angles de120°
Le cas le plus fréquent est celui d'un atome de
carbone comportant une double liaison, avec un autre carbone (éthylène et autres
alcènes), un oxygène (aldéhydes, cétones, acides carboxyliques, etc...), un
azote...
3ème cas n+m=2
- AX2
la molécule est linéaire (angle de 180°)
C'est le cas par exemple du dioxyde de carbone,
du cyanure d'hydrogène...
Géométrie
des molécules (fiche)