LES HALOGENOALCANES (RX)
1) Nomenclature
2) Propriétés physiques
3) Propriétés chimiques
4) Etude d'un mécanisme réactionnel
5) Résumé
Il s'agit de dérivés halogénés obtenus par remplacement d'un
ou plusieurs atomes d'hydrogène d'un alcane par un atome d'halogène.
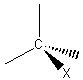
1) Nomenclature.
Deux façons officielles de les nommer sont utilisées :
- soit les préfixes fluoro ; chloro ; bromo ou iodo.
Exemple 1 :
CH3-Cl : chlorométhane.
Exemple 2 :
- soit le terme halogénure de…. (fluorure de ; chlorure de ; bromure de ou iodure de…..).
Exemple :
CH3Cl : Chlorure de méthyle
- Le nom d'usage est parfois le plus utilisé.
Exemples :
CCl4 : tétrachlorure de carbone.
CHCl3 : chloroforme.
2) Propriétés physiques.
A la température ambiante la majorité des halogénoalcanes se présentent sous
forme liquide.
Les dérivés chlorés sont moins denses que l'eau.
Les dérivés bromés et iodés sont plus denses que l'eau.
Ce sont d'une façon générale des composés odorants.
Ils sont incolores, insolubles dans l'eau, mais solubles dans l'éther l'alcool
et le benzène et constituent d'excellents solvants pour de nombreuses
substances organiques.
3) Propriétés chimiques.
La grande différence d'électronégativité entre l'élément carbone et l'halogène
provoque une forte polarisation de la liaison C-X. Cette polarisation de la
liaison est responsable des principales propriétés chimiques des
halogénoalcanes.
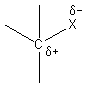
3-1) Action sur les métaux.
3-1-1)
Synthèse de Würtz.
![]()
3-1-2) Action sur le magnésium.
Cette réaction permet de former des organomagnésiens à condition de travailler
en milieu rigoureusement anhydre et à l'abri de l'air. L'importance de ces
composés est liée à leur grande réactivité. Cette propriété est mise à profit
dans leur utilisation comme intermédiaires réactionnels dans de nombreuses synthèses
organiques.
![]()
3-2) Réactions
d'élimination.
C’est la réaction inverse de l'addition sur une double liaison.
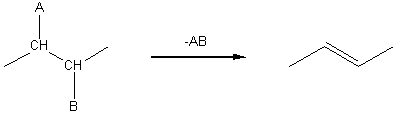
Si A est : H et B : un halogène et s'ils sont en position a on obtient une liaison éthylénique.
Ces réactions d'éliminations sont favorisées par une élévation de température
et la présence de groupements basiques puissants. (base forte : soude, potasse,
ions amidure NH2-,
ion alcoolate C2H5O-).
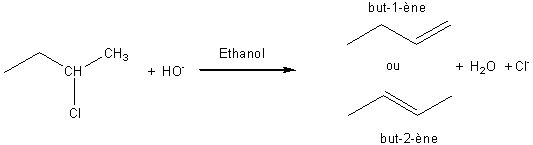
L'orientation de la réaction d'élimination est donnée par la règle de Zaïtsev :
Lors d'une élimination, si la double liaison peut se former en deux
positions, elle se forme de préférence avec le carbone qui porte le moins d'atomes
d'hydrogène.
Dans l'exemple ci-dessus le but-2-ène se forme préférentiellement.
Remarque : Les deux principaux mécanismes d'éliminations sont :
- Mécanisme E1 monomoléculaire lorsque le carbocation susceptible de se former est très stable.
- Mécanisme E2 bimoléculaire lorsque l'élimination se fait en milieu fortement basique.
3-3) Réactions de substitution.
La substitution de l'halogène se fait avec départ de HX (halogénure d'hydrogène)
ou (d'halogénure métallique) MX. La coupure de la liaison C-X se fait
hétérolytiquement :
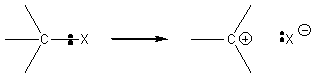
L'attaque par le substituant de la liaison carbone halogène C-X (fortement
polarisée) se fera nécessairement par des réactifs dits nucléophiles.
Un réactif nucléophile est un réactif qui va rechercher un site chargé
positivement (tendance à se fixer sur C+), il sera donc chargé négativement
(anion) ou il s'agira d'une molécule neutre dont un de ses atomes sera porteur
d'un doublet libre d'électrons.
Exemples de réactifs nucléophiles :
- chargé négativement et noté d'une façon générale Nu- : cyanure CN- ; alcoolate RO- ; nitrite NO2- etc..
- molécule avec un site porteur d'un doublet libre notée ½ Nu : l'eau H2O ; l'ammoniac NH3 ; etc..
Exemples de substitutions nucléophiles :
- action du cyanure CN- :
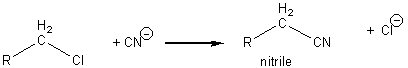
- action d'un alcoolate :
![]()
cette réaction est en compétition avec la réaction d'élimination rencontrée au
paragraphe précédent.
- action
sur l'eau :
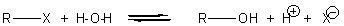
- action de l'ammoniac : réaction d'Hofmann qui est une méthode de préparation des amines.
![]()
4) Etude d'un mécanisme réactionnel : la substitution nucléophile.
Les deux principaux types de substitutions seront : les réactions d'ordre 1,
monomoléculaires et les réactions d'ordre 2, bimoléculaires.
4-1) Substitution nucléophile du premier ordre SN1.
Dans le cas d'une réaction d'ordre 1 la vitesse de réaction est proportionnelle
à la concentration de l'halogénoalcane et indépendante de la concentration du
réactif nucléophile.
La loi de vitesse apparaît sous la forme : ![]() .
.
Le mécanisme fait apparaître deux étapes :
- la première lente (limitante par sa vitesse) correspondant à la formation du carbocation intermédiaire C+,
- la seconde rapide correspondant à l'attaque du réactif nucléophile sur le carbocation précédemment formé.
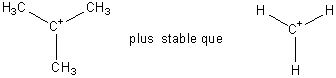
Un tel mécanisme n'est envisageable
que si le carbocation intermédiaire formé est stable. La stabilité du
carbocation est favorisée par toute influence électronique permettant de
diminuer la charge positive sur le C central (effet inducteur). Les
carbocations les plus stables seront les tertiaires.
Mécanisme SN1 monomoléculaire :
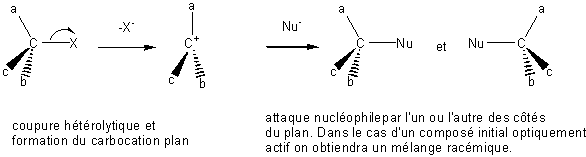
Exercice : Appliquer ce type de mécanisme à la réaction d'hydrolyse
en milieu basique du 2-phényl-2-chorobutane sachant qu'elle conduit au 2-phénylbutan-2-ol.
Montrer que les deux molécules obtenues ont l'une la configuration R l'autre S.
4-2) Substitution
nucléophile du second ordre SN2.
Dans le cas d'une réaction d'ordre 2 la vitesse de réaction est proportionnelle
à la concentration de l'halogénoalcane et du réactif nucléophile.
La loi de vitesse apparaît sous la forme : ![]() .
.
Le mécanisme fait apparaître une seule étape avec un état de transition, une
condition est nécessaire pour qu'un tel mécanisme soit possible, les
substituants du carbone portant l'halogène ne doivent pas être trop encombrants
pour que l'approche du réactif nucléophile ne soit pas gênée.
L'attaque se fait sur le côté opposé à l'halogène et conduit à une inversion de
la configuration (inversion de Walden).
Mécanisme SN2 bimoléculaire :
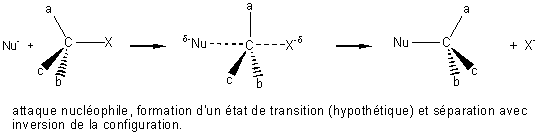
Exercice : Ecrire la réaction d'hydrolyse du chlorure de méthyle.
Constatez-vous dans ce cas une inversion de la configuration ?