DETERMINATION DE LA COMPOSITION D'UN PEPTIDE
1) Position du problème:
Pour déterminer la composition
d'un peptide, il faut connaître les acides aminés qui le composent ainsi que
l'ordre dans lequel ils sont enchaînés.
On procède en déterminant la
nature de l'acide aminé N-terminal de la chaîne. On s'intéresse à celui -ci car
il possède un groupement amino (NH2-) libre.
2) Diverses méthodes:
On distingue deux types de méthodes:
- Celles
qui permettent d'identifier l'acide aminé N-terminal, le reste de la chaîne du
peptide étant complètement dégradé lors de cette opération et donc inutilisable
pour la détermination de l'agencement des autres aminoacides présents dans la
chaîne . C'est par exemple la méthode de Sanger ou la méthode des
dansylaminoacides (DNS-AA).
- Celles
qui permettent de détacher l'aminoacide terminal de la chaîne, en conservant
le reste intact, d'identifier le maillon terminal ainsi détaché, puis de
détacher le suivant, l'identifier et ainsi de suite.
De telles méthodes sont dites récurrentes (la
récurrence désigne, la suite renouvelée d'opérations semblables). C'est le cas
de la méthode d'Edman.
3) Méthodes non récurrentes:
3-1) Méthode de Sanger:
Le peptide est traité par le 2,4-dinitrofluorobenzène
(DNFB). Le groupement amino de l'acide aminé terminal joue le rôle de réactif
nucléophile pour le DNFB et se substitue à l'atome de fluor sur le noyau
aromatique:

On hydrolyse ensuite le peptide :
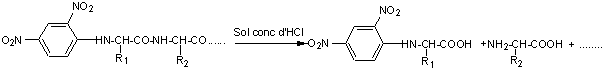
puis on identifie l'acide aminé marqué (Dinitrophénylaminoacide ou DNP-AA) par chromatographie par exemple.
3-2) Méthode des dansylaminoacides (ou méthode de Gray et
Hartley).
On utilise le chlorure de l'acide 5-diméthylaminonaphtalène-1-sulfonique (ou
chlorure de dansyle) 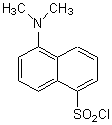 pour réagir avec
le groupement amino terminal du peptide:
pour réagir avec
le groupement amino terminal du peptide:
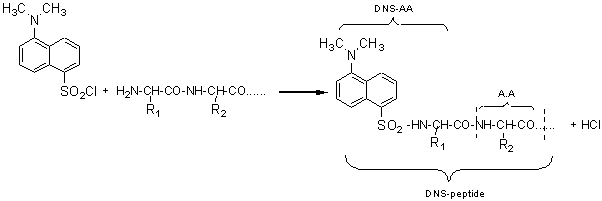
Cette opération est suivie d'une hydrolyse acide du DNS-peptide, qui
conserve le DNS-AA et décompose le reste de la chaîne en aminoacides séparés.
Le DNS-AA fortement fluorescent en lumière UV est facilement repérable lors
d'une chromatographie comparative.
Cette méthode a supplanté la méthode de Sanger car elle est beaucoup plus
sensible.
4) Méthode récurrente d'Edman (ou méthode
des phénylthiohydantoïnes):
Elle se produit par étapes; le processus est le même que pour les précédentes,
sauf que lors de l'hydrolyse acide du peptide "marqué" le reste de la
chaîne n'est pas dégradé et l'opération peut se renouveler avec l'aminoacide
terminal...
Le réactif utilisé est l'isothiocyanate
de phényle 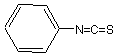 .Il y a addition avec le
groupe amino terminal:
.Il y a addition avec le
groupe amino terminal:
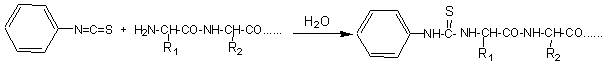
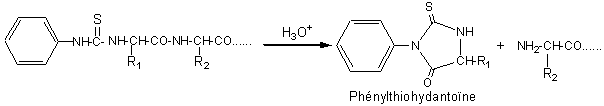
On hydrolyse ensuite en milieu acide, mais plus dilué que dans la méthode de
Sanger, et on forme une phénylthiohydantoïne, que l'on identifie par
chromatographie comparative.
On recommence à traiter le reste de la chaîne par l'isothiocyanate de phényle
et ainsi de suite.....
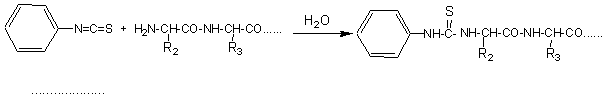
On détermine ainsi la séquence d'aminoacides dans le peptide.
Cette méthode est utilisée dans les automates (séquenceurs).