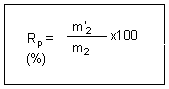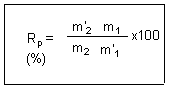LES
RENDEMENTS EN T.P.
RETOUR
AU SOMMAIRE
1) Quantité théorique
- Masse théorique :
Lors d'une synthèse,
la quantité maximale de produit préparé que l'on peut
espérer obtenir est désignée par "quantité
théorique" ; s'en déduit la masse théorique.
La quantité théorique
résulte de la stoechiométrie de la réaction (coefficients
de l'équation équilibrée traduisant la synthèse)
ainsi que des quantités de réactifs utilisées au départ.
Exemple:
-
L'équation de la synthèse
d'un composé C est:
3A + 2B = 4C
+ D
-
Les quantités des réactifs
A et B utilisés sont au départ:
nA = 0,300 mole
nB = 0,300 mole
a) Détermination du réactif limitant la réaction:
On compare les quantités 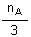 et
et 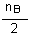 , les dénominateurs
de ces fractions étant respectivement les coefficients de A et de
B dans l'équation:
, les dénominateurs
de ces fractions étant respectivement les coefficients de A et de
B dans l'équation:
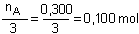
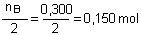
Comme 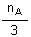 (0,100
mol) est inférieur à
(0,100
mol) est inférieur à 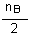 (0,150
mol) c'est le réactif A qui limitera la réaction (celui qui
viendra le premier à épuisement).
(0,150
mol) c'est le réactif A qui limitera la réaction (celui qui
viendra le premier à épuisement).
b) Détermination de la quantité théorique de
produit C:
On raisonne à partir
du réactif limitant A ; la stoechiométrie nous impose :
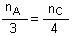 soit
soit 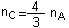
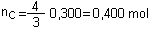
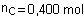
Remarque:
On
peut également pour ces déterminations utiliser un tableau
d'évolution:
3A +
2B = 4C + D
Tableau
d'évolution:
|
x
|
A
|
B
|
C
|
D
|
|
Début
|
0
|
0,300
|
0,300
|
0
|
0
|
|
Fin
|
xmax
|
0,300-3xmax
|
0,300-2xmax
|
4xmax
|
xmax
|
a) Réactif limitant la réaction:
1èrehypothèse:
C'est A qui est réactif limitant
On
a alors 0,300-3xmax=0
soit xmax=
0,300/3 = 0, 100 mol
Conséquence:
Il
reste: 0,300 - 0,200 = 0,100 mol de B . Cette quantité est positive
..L'hypothèse de départ est la bonne.
Le
réactif limitant est A.
b) Quantité théorique de produit C :
4xmax=
4x0,100 = 0,400 mol.
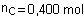
2) Masse effective -
Rendement d'une synthèse :
2-1) Masse effective :
A chaque opération,
on "perd" un peu du produit préparé :
- Lors
d'une filtration, par exemple, du produit reste sur le papier filtre, malgré
le soin que l'on met à essayer de le recueillir complètement.
- Lors
d'un lavage ou d'une recristallisation, un peu de produit préparé
reste en solution dans le solvant de lavage ou de recristallisation.
- Lors
d'une distillation, du liquide reste sur les parois intérieures
des pièces du montage....
La masse effective est
donc toujours inférieure à la masse théorique.
2-2) Rendement d'une synthèse :
On appelle rendement
d'une synthèse (complète, avec purification du produit
brut) le rapport entre la masse effective (masse totale de produit
pur) et la masse théorique.

3) Masse obtenue et masse
totale de produit pur :
-
Si on soumet à la purification
l'intégralitédu
produit brut, la masse de produit pur obtenue correspond
à la masse totale de pur entrant dans le calcul de
RS.
-
Si on ne purifie qu'une
partie du produit brut, la masse de produit pur que l'on
obtient ne correspond pas à la masse totale de pur
; on peut déterminer cette dernière à partir de la
masse obtenue.
Exemple : Appelons,
m la masse totale de produit
brut obtenue lors de la réaction de synthèse.
m2
la
masse de produit brut mis à recristalliser.
m'2
la
masse du produit pur sec obtenue.
Le calcul de la masse
totale de pur se fait de la manière suivante :
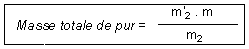
C'est la masse que l'on aurait
effectivement obtenue en recristallisant tout le brut.
Il suffit ensuite de diviser
cette masse calculée par la masse théorique pour avoir le
rendement de la synthèse.
4) Rendement de la purification
:
Bien que le rendement d'une
synthèse soit la grandeur la plus intéressante à connaître,
on peut parfois vouloir savoir quel a été le rendement d'une
opération particulière par exemple le rendement de la purification.
Prenons le cas d'un solide
:
Le produit
brut contient des impuretés:
-
Soit solides qui sont mélangées
au solide préparé,
-
Soit liquides qui imprègnent
le solide préparé.
Lors de la purification, on
débarrasse le solide préparé de l'ensemble de ses
impuretés.
On appelle rendement
de la purification :

Ainsi si m2
est
la masse de produit brut mis à recristalliser
et m'2
la masse du
produit pur sec obtenue :
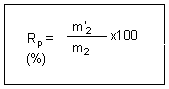
Remarque : On calcule
parfois le rendement de la purification en considérant que cette
opération n'enlève que les impuretés solides du produit
brut. Pour cela on fait sécher à l'étuve la partie
non purifiée du produit brut pour le débarrasser de ses impuretés
liquides et on se livre au calcul suivant:
m la masse
totale de produit brut obtenu lors de la réaction de synthèse.
m1
la
masse de produit brut humide mis à sécher.
m'1
la
masse du produit brut sec.
m2
la
masse de produit brut humide mis à recristalliser.
m'2
la
masse du produit pur sec obtenu.
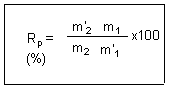

![]()