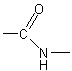
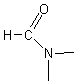
SPECTROSCOPIE RMN
Plan de la
leçon:
1) Principe :
2) Appareillage :
3) Blindage des noyaux :
4) Déplacement
chimique :
5) Utilisation des spectres
RMN :
6) Exercice:
La spectrométrie de R.M.N.
(Résonance Magnétique Nucléaire) est basée sur les propriétés magnétiques de
certains noyaux atomiques.
Nous n'étudierons que la R.M.N. du proton donc du
noyau de l'atome d'hydrogène 1 H.
1) PRINCIPE
- Tous les noyaux atomiques possèdent une charge en
rotation, identifiée sous le nom de spin nucléaire (ils sont
assimilables à des petits aimants et de ce fait peuvent présenter un moment
magnétique nucléaire).
Remarque :
Certains noyaux ne sont pas observables en R.M.N. car ils n'ont pas de
propriétés magnétiques.
Sous l'action d'un champ magnétique externe
uniforme, le noyau atomique (son moment magnétique nucléaire) peut prendre
différentes orientations.
A ces différentes orientations, correspondent
différents niveaux d'énergie :
- l'un de basse énergie, si le moment magnétique est
parallèle et de même sens que le champ extérieur,
- l'autre d'énergie plus élevée, si le sens est
contraire.
La différence d'énergie DE entre ces deux états est proportionnelle au champ extérieur. La transition du niveau bas au niveau haut peut avoir lieu par absorption d'une radiation de fréquence n telle que DE = hn .
Lorsque la transition a lieu, on dit qu'il y a résonance du noyau.
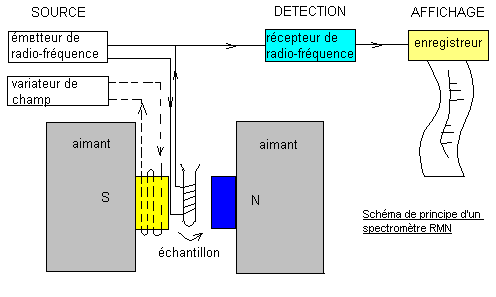
-
La surface des pics est proportionnelle au nombre de noyaux qu'ils
représentent.
- Les spectromètres sont équipés d'un intégrateur qui
traduit cette surface en une courbe, dite courbe d'intégration, dont le tracé
correspond aux pics d'absorption.
-
Lorsqu'on soumet une molécule à un champ magnétique externe, ce champ agit non
seulement sur les spins nucléaires, mais en même temps il induit dans un plan
perpendiculaire à sa direction, une circulation des électrons autour du proton.
D'où l'existence d'un champ magnétique interne.
- Ce champ peut s'additionner au champ extérieur :
c'est le phénomène de déblindage
- Ce champ peut s'opposer au champ extérieur : c'est
le phénomène de blindage ou d'écran.
Plus le blindage est intense, plus le proton doit
être soumis à un champ extérieur fort pour que se produise la résonance. Ceci
se traduit par un déplacement des pics d'absorption vers la droite du spectre.
L'inverse dans le cas du déblindage.
L'intensité du blindage ou du déblindage dépend donc
de l'environnement du proton, donc de la structure chimique du composé, et en
particulier est très sensible à la présence d'électrons p ou
d'électrons libres.
Si les protons ont le même environnement chimique ils
résonnent pour le même champ : ils sont dits équivalents.
4) DEPLACEMENT CHIMIQUE OU GLISSEMENT CHIMIQUE
- Pour
apprécier quantitativement le blindage que subit un proton on doit utiliser une
référence.
On utilise le signal que donnent les protons du
tétraméthylsilane - TMS - Si(CH3)4
que l'on introduit en petite quantité (1 à 2 %) dans l'échantillon. Cet étalon
interne présente de nombreux avantages :
- Les 12 protons ont le même environnement chimique
et fournissent un seul signal.
- Il est utilisable en faible quantité car son
absorption est intense.
- Sa résonance a lieu à champ plus fort que dans la
plupart des cas donc son pic d'absorption est bien séparé des autres et à
l'extrême droite de l'enregistrement.
- Il présente une grande inertie chimique et ne
risque pas de réagir avec l'échantillon.
- Il est très volatil ( Teb = 20°C ) et
s'évapore facilement de l'échantillon.
Ce pic constitue l'origine de l'échelle
de mesure.
Pour un proton, l'écart entre la valeur du champ pour
lequel il résonne et cette origine constitue son déplacement chimique
par rapport au TMS. Cette différence peut être exprimée en unité de champ
magnétique ou en Hertz.
Pour éviter des problèmes
d'unités, on définit une grandeur sans unité, elle aussi appelée :
déplacement chimique d .d s'exprime en ppm (parties par million).
|
Type de proton |
Type de proton |
d en ppm |
|
|
-CH-C |
0,8 à 1 |
-CH-X |
2,5 à 4 |
|
-CH-C-C-X |
0,8 à 1,2 |
-CH-O-C=O |
3,7 à 4,8 |
|
-CH-C=C- |
1,6 à 2,2 |
|
4,5 à 5,3 |
|
-CH-C-X |
1 à 1,8 |
Ar-H |
6 à 8 |
|
-CH-C-CN |
2 à 3 |
R-NH- |
1 à 5 |
|
|
2,1 à 3 |
R-OH |
1 à 6 |
|
|
2,3 à 3,2 |
|
5,5 à 8,5 |
|
-CH-C=O |
2 à 2,7 |
|
8 |
|
-CH-Ar |
2,3 à 3 |
R-CHO |
9,5 à 9,9 |
|
-CH-O |
3 à 4 |
R-COOH |
10 à 13 |
|
-CH-O-Ar |
3,7 à 4,3 |
|
|

5)UTILISATION D'UN SPECTRE RMN
5-1) Aspect d'un spectre:
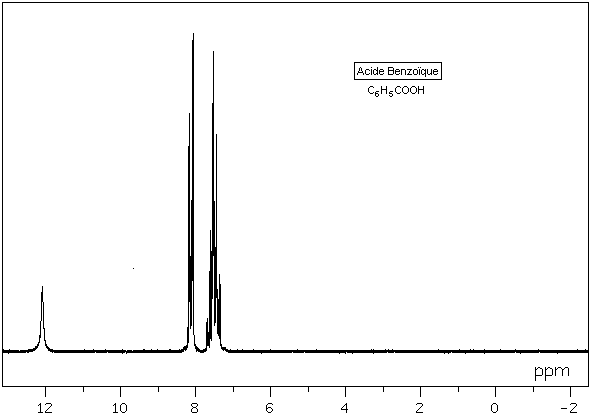
5-2) Méthode
d'interprétation d'un spectre
La suite chronologique des informations à exploiter
est :
- le nombre de signaux et la valeur du déplacement
chimique correspondant, ce qui permet d'identifier le nombre et la nature des
groupes de protons équivalents ; (en utilisant une table de données) ;
- la courbe d'intégration qui donne le nombre de
protons de chaque type ; (l'aire de chaque pic est proportionnelle au nombre de
protons responsables du pic. Sur la courbe d'intégration la distance entre deux
paliers est proportionnelle à la surface du pic correspondant et donc au nombre
de protons.) ;
- la forme de chaque signal qui renseigne sur le
nombre de protons voisins du proton étudié. (un signal peut être constitué de
plusieurs pics. Ce phénomène est lié à la présence des protons voisins et est
appelé couplage spin-spin. En pratique un proton ou un groupe de protons
équivalents ayant n protons voisins donnera un signal constitué de (n+1) pics,
appelé multiplet(singulet : 1 pic;doublet : 2 pics;triplet : 3 pics;quadruplet
: 4 pics;quintuplet : 5 pics....)).
Remarques :
- S'il n'y a pas de courbe d'intégration, on trouve
parfois, au dessus du signal un chiffre qui est égal ou proportionnel au nombre
de protons correspondant au signal.
- Si le produit analysé est un acide carboxylique la
résonance est obtenue pour un déplacement chimique 10<d
<13. Si les spectres ne sont gradués que jusqu'à 10 ppm, on effectue un
changement d'échelle ("offset"). Ce changement d'échelle est, en
général, donné en Hz et il faut le recalculer en ppm d'après la formule (106.Dn/n0);Dn est
le décalage offset affiché. A cette valeur de d on doit ajouter la
valeur du déplacement chimique où apparaît ce pic pour obtenir le déplacement
chimique réel d .
- Les intensités relatives des pics constituant des
multiplets sont entre elles comme les coefficients du polynôme (a+b)n avec
n représentant le nombre de protons voisins:
n = 1
doublet 1:1
n = 2
triplet 1:2:1
n = 3
quadruplet 1:3:3:1
n = 4
quintuplé 1:4:6:4:1
Attention! la multiplicité des pics ne dépend pas du
nombre de protons qui résonnent, mais de ceux de leurs voisins.
5-3) Exemples :
- Exemple 1:
Oncosidère une molécule de formule brute C7H14O.
On examine son spectre IR:
puis on examine son spectre RMN (reconstitué):
On souhaite en déduire sa formule semi-développée.
Raisonnement:
- Du spectre IR on déduit que cette molécule porte une
fonction cétone.
- Spectre RMN:
courbe intégrale:
La somme des hauteurs des "marches" a+b+c
donne 28mm qui correspondent à 14H (déduit de la formule brute) soit 14/28 =
0,5H par mm.
On en déduit que
a correspond à 18x0,5 = 9H
b correspond à 6x0,5 = 3H
c correspond à 4x0,5 = 2H
signaux RMN:
Les 9 protons qui résonnent à 0,9 ppm correspondent à
3 -CH3 ayant le même environnement chimique loin de la fonction
cétone.
Les 3 protons qui résonnent à 2,1 ppm correspondent à
1 -CH3 voisin de la fonction cétone.
Les 2 protons qui résonnent à 2,6 ppm correspondent à
1 -CH2 voisin de la fonction cétone.
Conclusion:En regroupant ces renseignements on
trouve que la molécule de formule brute C7H14O
a comme formule semi-développée:
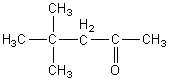 c'est la 4,4-diméthylpentan-2-one.
c'est la 4,4-diméthylpentan-2-one.
- Exemple 2 :
On considère la molécule de formule brute C5H10O
On examine son spectre IR
puis on
examine son spectre RMN (reconstitué):
Raisonnement:
- Du spectre IR on déduit que cette molécule porte une
fonction cétone.
- Spectre RMN:
signaux RMN:
On distingue deux groupes de protons, l'un qui
résonne à 1ppm environ et qui forme un triplet, l'autre qui résonne à 2,5ppm
environ et qui forme un quadruplet.
Le premier correspond à des H éloignés de la fonction
cétone tandis que le second correspond à des H voisins de la fonction cétone
(voir tableau des glissements chimiques).
Le triplet veut dire que les protons qui résonnent à
1ppm sont couplés avec deux protons voisins, tandis que le quadruplet veut dire
que les H qui résonnent à 2,5ppm sont couplés avec 3 H voisins.
courbe intégrale:
La somme des hauteurs des "marches"
a+b+c+a'+b'+c'+d' donne 28mm qui correspondent à 10H (déduit de la formule
brute) soit 10/28 = 0,357 H par mm.
On en déduit que
a+b+c correspond à 16,8x0,357 = 6H
a'+b'+c'+d' correspond à 11,2x0,357 = 4H
Il en résulte que le groupe de protons qui résonnent
à 1ppm est formé de deux CH3- et celui des protons qui résonnent à 2,5ppm est formé de
deux CH2-
Conclusion:En regroupant ces renseignements on
trouve que la molécule de formule brute C5H10O a
comme formule semi-développée:
![]() C'est la pentan-3-one.
C'est la pentan-3-one.
5-4) Conclusion
- L'étude du spectre RMN permet lors de l'étude de la
structure d'une molécule d'apporter un certain nombre de renseignements
relatifs à la formule développée et parfois à sa stéréochimie.
- Cette technique est utilisée depuis quelques
dizaines d'années dans le domaine médical. Elle porte alors le nom de I.R.M.
Imagerie par Résonance Magnétique.
6) EXERCICE:
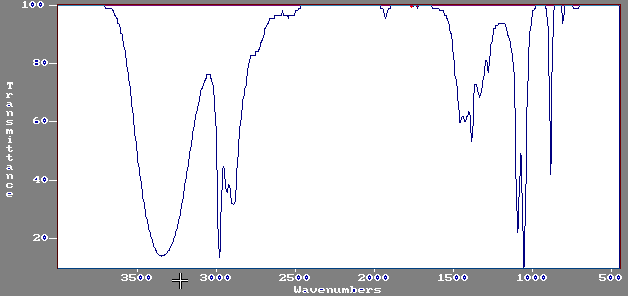
On considère une molécule de formule brute C2H6O.
Son spectre IR est le suivant:
Son spectre RMN est le suivant:
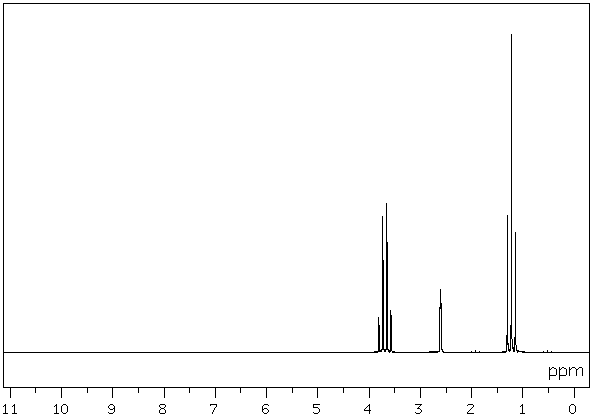
Commentez les deux spectres et en déduire la formule semi-développée de cette
molécule et son nom.