3-2) Calcul du rendement de la préparation.
3-2-1) Déterminer les quantités de matière de tous
les réactifs introduits lors de la réaction d’oxydation.
En déduire le réactif limitant, sachant qu’une mole d’acétophénone
réagit avec trois moles de dichlore et que les ions hydroxyde sont
en excès.
3-2-2) Calculer la masse théorique mthéo d’acide benzoïque
attendu. Donner l’expression du rendement de la préparation.
3-3) Obtention du produit brut.
3-3-1) Préciser le rôle de l’ajout de la solution d’hydrogénosulfite
de sodium. Écrire l’équation de la réaction qui se
produit alors (les demi-équations d’oxydoréduction sont demandées).
3-3-2) Expliquer pourquoi il est prudent de refroidir le mélange
réactionnel avant le lavage au dichlorométhane.
3-3-3) Indiquer la nature des produits éliminés lors du lavage
au dichlorométhane.
3-3-4) Expliquer le rôle de l’ajout d’acide chlorhydrique, en écrivant
l’équation de la réaction qui se produit lors de cet ajout.
Quel est l’intérêt de refroidir le bécher dans ce cas
? Indiquer enfin pourquoi le pH doit être assez bas à la fin
de l’addition de l’acide chlorhydrique.
4)
Recristallisation.
Indiquer
les propriétés que doit posséder un solvant de recristallisation.
5)
Contrôle
de pureté.
Interpréter
le chromatogramme fourni ; les calculs des Rf sont demandés.
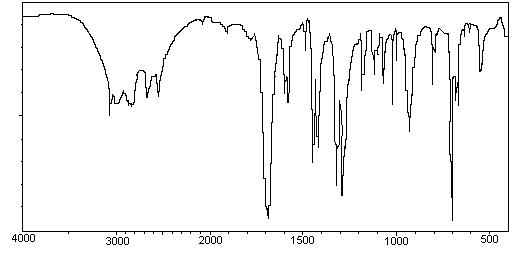
6)
Spectroscopie
infrarouge.
Repérer
sur les deux spectres IR fournis, les bandes dont la disparition ou l’apparition
permettent de montrer que la réaction a eu lieu.

Dépôt n°
1 : acétophénone de référence
Dépôt n°
2 : acide benzoïque de référence
Dépôt n°
3 : produit pur sec
Coller ici la CCM obtenue
|
Masse de produit brut humide mis à sécher |
m1 = |
|
Masse de produit brut sec |
m’1 = |
|
Masse de produit brut humide à recristalliser |
m2 = |
| Volume V de solvant utilisé pour la recristallisation | V = |
| Masse de produit purifié sec | m’2 = |
| Aspect du produit purifié sec | |
| Température de fusion du produit purifié | Tfus = |
| Rendement en produit purifié | R = |