PREPARATION DE L' ETHANOATE
DE BENZOINE
Corrigé du compte rendu :
1) Questions:
1.1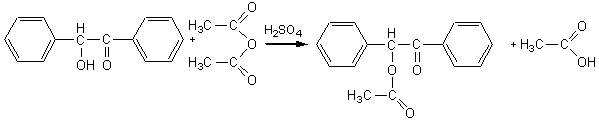
Benzoine (C14H12O2) anhydride acétique (C4H6O3)
acétate de benzoine (C16H14O3)
acide acétique (C2H4O2)
1-2
Groupement acétyle:![]() Ici, la réaction d'estérification peut aussi s'appeler
acétylation puisque l'on fixe le groupement acétyle sur la benzoine.
Ici, la réaction d'estérification peut aussi s'appeler
acétylation puisque l'on fixe le groupement acétyle sur la benzoine.
1-3 L'anhydride éthanoïque est utilisé pour augmenter
le rendement; en effet la réaction est totale, contrairement à l'estérification
par l'acide éthanoïque, qui donne lieu à un équilibre (En effet l'action de
l'eau formée sur l'ester, redonne l'acide et l'alcool de départ).Dans cette
acétylation le produit formé en plus de l'ester est l'acide éthanoïque qui ne
réagit pas sur l'ester.
1-4 Le rôle de l'acide sulfurique concentré est double: il joue le rôle de catalyseur de la réaction (il augmente sa vitesse) et il maintient le milieu anhydre.
1-5
L'acide éthanoïque mis au départ dans le milieu (20mL) a servi de solvant de la
benzoine (il faut travailler en phase liquide
et la benzoine est un solide). Mais il va y avoir
compétition entre deux réactions: l'acétylation par l'anhydride, souhaitée et
l'estérification par l'acide, non souhaitée car elle conduit à de l'eau.Heureusement l'acétylation est plus rapide que
l'estérification par l'acide. Néanmoins il y aura une petite proportion de
molécules qui réagira avec l'acide et c'est pour éliminer l'eau formée et
l'empêcher de réagir sur l'ester que l'on a mis un gros excès d'anhydride. En
effet l'anhydride au contact de l'eau donne la réaction:
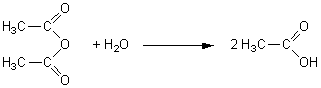
1-6 L'eau froide va permettre la cristallisation du
solide préparé qui n'est pas soluble dans l'eau; elle est mise en grande
quantité, pour dissoudre les acides qui sont solubles dans l'eau, c'est à dire
pour commencer à purifier en partie le produit brut.
1-7 La recristallisation, est une opération destinée à finir d'enlever les impuretés qui subsistent.Si l'on fait le bilan des impuretés après le reflux, on trouve l'acide acétique, l'acide sulfurique, et éventuellement de la benzoine qui n'aurait pas réagi. L'eau a enlevé les acides (mais pas la benzoine qui n'est pas soluble dans l'eau). Il reste donc la benzoine qu'il faut enlever par recristallisation.
1-8 Le
solvant de recristallisation est l'éthanol à 95%.La qualité première d'un
solvant de recristallisation est de dissoudre le produit préparé et les
impuretés à éliminer à chaud, et de ne dissoudre à froid que les impuretés.
En outre, il ne doit pas réagir avec les corps
présents dans le milieu, son point d'ébullition doit être inférieur à celui du
produit préparé, il doit être assez volatil et le moins onéreux possible.Lorsqu'on ne trouve pas un solvant qui répond à
ces critères on peut prendre un mélange de solvants.
1-9 D'après ce que nous venons de dire en 1-8, la benzoine étant l'impureté à éliminer, elle doit être très soluble dans l'éthanol à 95%.
2) Rendement:
Le tableau des réactifs donne nbenzoine= 0,092
mole nanhydride=
0,22 mole
Les coefficients stoechiométriques
des réactifs étant égaux, c'est la benzoine qui
limite la réaction.
Une mole de benzoine donne
une mole d'ester. La masse théorique d'ester est donc nth= 0,092mol.
La masse théorique d'ester est mth=
0,092x254 = 23,4g