SYNTHESE
DE LA 5,5-DIPHENYLHYDANTOÏNE
Synthèse d’un agent anticonvulsivant, la
5,5-diphénylhydantoïne ou phénantoïne :
Il est demandé de
commencer la synthèse de la phénantoïne (2ème étape) avant de
procéder à l’oxydation de la benzoïne (1ère étape).
La phénantoïne, découverte par le chimiste allemand Justus Liebig
en 1838, est l’un des médicaments, avec le phénobarbital, les plus utilisés
pour le traitement de l’épilepsie. On se propose ici de synthétiser la
phénantoïne à partir de la benzoïne en deux étapes.
1) Première étape : oxydation de la benzoïne en benzile par l’acétate de
cuivre (II)
L’équation de la réaction
est :
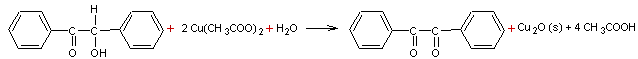
1-1) Suivi de l’évolution de la réaction.
On
souhaite suivre l’évolution de cette réaction par chromatographie sur couche
mince.
Préparer
trois plaques de silice. Sur chaque plaque, faire les dépôts suivants :
· la benzoïne de départ (solution à 1 % dans l’acétone)
· le benzile commercial (solution à 1 % dans l’acétone);
· des dépôts du milieu réactionnel à des temps
différents :
Plaque 1 :
t = 1 min de reflux, t = 5 min, t = 10 min
Plaque 2 :
t = 15 min, t = 20 min, t = 25 min
Plaque 3 :
t = 30 min, t = 35 min.
Pour
cela, on prélèvera rapidement et avec
précaution à l’aide d’une pipette pasteur, quelques gouttes du mélange
réactionnel toutes les cinq minutes que l’on diluera dans un petit tube à
hémolyse contenant 5 mL d’acétone.
L’éluant est un
mélange cyclohexane – éthoxyéthane (1/3 – 2/3). La révélation sera effectuée
sous UV à 254 nm.
1-2) Mode opératoire de la synthèse :
Dans un
ballon de 100 mL convenablement équipé introduire 2,00 g de benzoïne, 3,80 g
d’acétate de cuivre monohydraté, 15 mL d’acide acétique glacial et 5 mL d’eau.
Porter le
mélange à reflux. Déclencher le chronomètre dès que le mélange est à reflux.
Effectuer les différents prélèvements. Révéler les plaques CCM au fur et à
mesure.
Arrêter
le reflux lorsque que l’on peut considérer que la réaction est terminée (le
reflux ne doit pas dépasser 45 min). Noter sur la feuille réponse le temps de
reflux jugé nécessaire pour effectuer cette synthèse.
Filtrer
sur büchner le mélange réactionnel chaud.
Transvaser
le filtrat dans un bécher de 250 mL, rincer la fiole à l’eau glacée et
refroidir le bécher de façon à ce que la cristallisation soit complète.
Mesurer
le pH du filtrat avant le premier lavage.
Filtrer
sur büchner, laver le gâteau avec de l’eau glacée en contrôlant la qualité des
lavages (de nombreux lavages sont nécessaires). Faire contrôler la fin des
lavages par un membre du jury.
Essorer
et sécher le produit brut sur papier filtre. On appelle m1 la masse de produit brut humide.
Sécher le
produit à l’étuve à 80 °C. On appelle m2
la masse de produit brut sec
1-3) Analyse :
Mesurer la
température de fusion du benzile synthétisé.
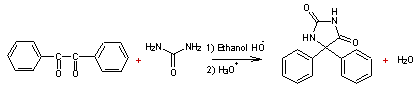
2) Deuxième étape : synthèse
de la phénantoïne à partir du benzile
L’équation de la réaction
est :
2-1) Mode opératoire :
Dans un ballon de 200 mL convenablement équipé, dissoudre 2,00 g de
benzile et 0,96 g d’urée dans 50 mL d’éthanol.
Ajouter 5 mL d’une solution aqueuse d’hydroxyde de potassium à 10
mol.L-1.
Chauffer à reflux pendant 2 h.
Après refroidissement à température ambiante, ajouter 150 mL d’eau
glacée en agitant.
Filtrer pour enlever le solide beige pâle qui est un sous-produit.
Transvaser le filtrat dans un bécher de 400 mL.
Ajouter au filtrat, goutte à goutte et en agitant, de l’acide
chlorhydrique à 6 mol.L-1 jusqu’à ce que la précipitation de la
phénantoïne soit complète.
Filtrer
et laver le produit à l’eau glacée. On appelle m3 la masse de produit brut humide. Partager cette masse
en deux. Soit m4 la masse
de produit brut humide mise à l’étuve.
Sécher à l’étuve. Soit m5
la masse de produit brut sec.
Recristalliser le reste de produit (masse m6) dans l’éthanol à 95 % en volume.
Sécher le produit à l’étuve (80 °C). On appelle m7 la masse de produit
purifié sec.
2-2) Analyse qualitative (chromatographie liquide haute
performance)
Donner au jury le produit purifié pour une analyse en CLHP
phase inverse (éluant : acétonitrile/eau (70/30) ; colonne en
C18 ; UV : 225 nm ; solvant : acétonitrile).
3) Données et sécurité :
(Toutes les valeurs de températures de changement d’état sont
données à p = 1,013 bar).
|
Acétate de cuivre monohydraté |
M = 199,65 g.mol-1 Soluble dans l’eau |
|
R 22 |
|
Acétonitrile |
M = 41,05 g.mol-1 |
|
R 11-20/21/22-36 S 16-36/37 |
|
Acide acétique glacial |
M = 60,05 g.mol-1 |
|
R10-35 S 23-2-26-45 |
|
Acide chlorhydrique |
|
|
R 8-35 S 1/2-23-26-36-45 |
|
Benzile |
M = 210,24 g.mol-1 Insoluble dans l’eau Soluble dans
l’acide acétique. |
|
R
36/37/38 S 26-36 |
|
Benzoïne |
M = 212,25 g.mol-1 tf = 133 °C Peu soluble dans l’eau Soluble dans l’acide acétique |
|
|
|
Cyclohexane |
M = 84,16 g.mol-1 Te = 81 °C d = 0,78 (à 298 K) |
|
R
11-38-50/53-65-67 S
9-16-25-33-60-61-62 |
|
Ethanol 95 % |
|
|
R 11 |
|
éthoxyéthane (éther diéthylique) |
M =
74,1 g.mol-1 Te
= 35 °C d
= 0,7 (à 298 K) |
|
R
12-19-22-66-67 S 2-9-16-29-33 |
|
Hydroxyde de potassium |
M =
56,1 g.mol-1 |
|
R 22-35 S
1/2-26-36/37/39-45 |
|
5,5-diphénylhydantoïne (phénantoïne) |
|
|
R
22/40/63 S 36/37 |
|
Acétone (propanone) |
M =
58,1 g.mol-1 Te
= 56 °C d
= 0,8 (à 298 K) |
|
R 11 S 2-9-16-23-33 |
|
Urée |
M =
60,1 g.mol-1 Soluble
dans l'eau |
|
|
4) Questions
4-1) Oxydation
de la benzoïne en benzile par l’acétate de cuivre (II).
a.
Calculer la masse
théorique de benzile attendue.
b.
Calculer le rendement de
cette préparation (R1).
c.
Interpréter les
différentes CCM et expliquer comment on peut ainsi déterminer le temps de
reflux suffisant pour effectuer cette synthèse.
d.
Citer une autre technique
de révélation de plaque CCM.
e.
Expliquer pourquoi les
cristaux sont lavés à l’eau froide et comment la qualité du lavage est
contrôlée.
4-2) Synthèse de la phénantoïne à partir du benzile .
a.
Calculer la masse
théorique de phénantoïne attendue.
b.
Calculer le rendement en
produit brut (R2), le rendement de la recristallisation (R3) ainsi que le
rendement en produit purifié (R4).
c.
Rappeler les critères
requis pour un bon solvant de recristallisation.
d.
Expliquer l’expression
« CLHP en phase inverse ».
e.
Que signifie C18 ?
4-3) Analyses.
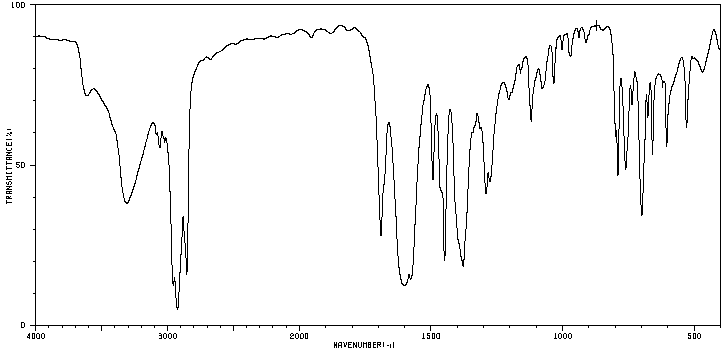
a.
Les spectres IR A et B donnés
en annexe 2 correspondent aux spectres des deux produits préparés. Identifier
chaque spectre en justifiant le choix retenu.
b.
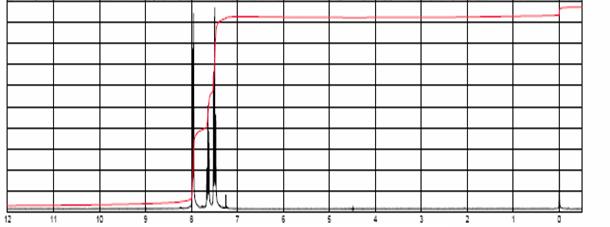
Le spectre RMN-1H du
benzile est fourni en annexe 1. Pour chacun des trois massifs, indiquer : la
gamme de déplacements chimiques, la hauteur du signal d'intégration (en cm), le
nombre de protons concernés et le groupe de protons correspondant.
Annexe 1 : spectre RMN-1H du benzile
Annexe 2 : Spectres infrarouge
Spectre A
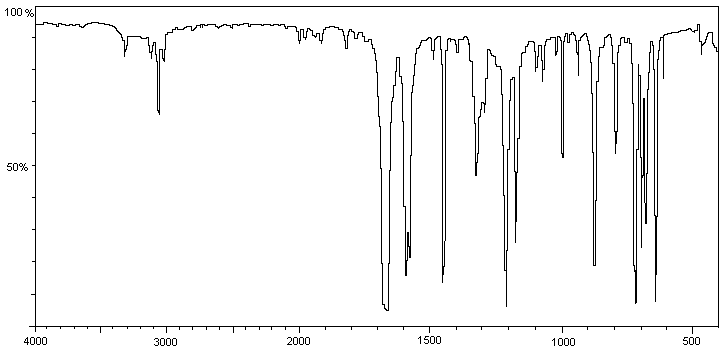
Spectre B
Spectroscopie
I.R.
Table des nombres d’onde des vibrations d'élongation et de
déformation
Ctet : C tétragonal Ctre : C trigonal >C= Cdi :
C digonal -Cº
|
Liaison |
Nature |
Nombre d’onde (cm-1) |
Intensité F : fort ; m : moyen ; f : faible |
|
O-H alcool libre |
Elongation |
3590-3650 |
F (fine) |
|
O-H alcool lié |
Élongation |
3200-3600 |
F (large) |
|
N-H amine |
Élongation |
3300-3500 |
m |
|
N-H amide |
Élongation |
3100-3500 |
F |
|
Cdi-H |
Élongation |
~ 3300 |
M ou f |
|
Ctri-H |
Élongation |
3030-3100 |
m |
|
Ctri-H
aromatique |
Élongation |
3000-3100 |
m |
|
Ctet-H |
Élongation |
2850-2970 |
F |
|
Ctri-H
aldéhyde |
Élongation |
2700-2900 |
m |
|
O-H acide carboxylique |
Élongation |
2500-3200 |
F à m (large) |
|
CºC |
Élongation |
2100-2260 |
f |
|
CºN nitriles |
Élongation |
2200-2260 |
F ou m |
|
C=O anhydride |
Élongation |
1800-1850 1740-1790 |
F |
|
C=O chlorure d’acide |
Élongation |
1790-1815 |
F |
|
C=O ester |
Élongation |
1735-1750 |
F |
|
C=O aldéhyde et cétone |
Élongation |
1700-1740 abaissement de ~ 20 à 30 cm-1 si conjugaison |
F |
|
C=O acide carboxylique |
Élongation |
1700-1725 |
F |
|
C=O amide |
Élongation |
1650-1700 |
F |
|
C=C |
Élongation |
1620-1690 |
m |
|
C=C aromatique |
Élongation |
1450-1600 |
Variable ; 3 ou 4 bandes |
|
N=O (de –NO2) Conjugué |
Élongation |
1500-1550 1290-1360 |
F |
|
N=N |
Élongation |
1400-1500 |
f ; parfois invisible |
|
C=N |
Élongation |
1640-1690 |
F ou m |
|
N-H amine ou amide |
Déformation |
1560-1640 |
F ou m |
|
Ctet-H |
Déformation |
1430-1470 |
F |
|
Ctet-H (CH3) |
Déformation |
1370-1390 |
F ; 2 bandes |
|
O-H |
Déformation |
1260-1410 |
F |
|
P=O |
Élongation |
1250-1310 |
F |
|
Ctet-O-Ctet
(étheroxydes) |
Elongation |
1070-1150 |
F |
|
Ctet-OH (alcools) |
Élongation |
1010-1200 |
|
|
Ctet-O-Ctri
(esters) Ctri-O-Ctri
(anhydrides) |
Élongation |
1050-1300 |
F ; 1 ou 2 bandes |
|
C-N |
Élongation |
1020-1220 |
m |
|
C-C |
Élongation |
1000-1250 |
F |
|
C-F |
Élongation |
1000-1040 |
F |
|
Ctri-H de -HC=CH- (E) (Z) |
Déformation Déformation |
960-970 670-730 |
F m |
|
Ctri-H
aromatique monosubstitué |
Déformation |
730-770 et 680-720 |
F ; 2 bandes |
|
Ctri-H
aromatique o-disubstitué m-disubstitué p-disubstitué |
Déformation Déformation Déformation |
735-770 750-800 et 680-720 800-860 |
F F et m ; 2 bandes F |
|
Ctri-H
aromatique 1,2,3
trisubstitué 1,2,4
trisubstitué 1,3,5
trisubstitué |
Déformation Déformation Déformation |
770-800 et 685-720 860-900 et 800-860 810-865 et 675-730 |
F et m ; 2 bandes F et m ; 2 bandes F et m ; 2 bandes |
|
Ctet-Cl |
Élongation |
600-800 |
F |
|
Ctet-Br |
Élongation |
500-750 |
F |
|
Ctet-I |
Élongation |
» 500 |
F |
Spectroscopie RMN du proton.
Domaines de déplacements chimiques des protons des groupes M
(méthyle CH3, méthylène CH2 et méthyne CH)
en a ou en b de groupes caractéristiques.
|
type de proton |
d en ppm |
type de proton |
d en ppm |
|
M‑CH2R M‑C=C M‑CºC M‑Ph M‑F M‑Cl M‑Br M‑I M‑OH
et M‑OR M‑OPh M‑O‑CO‑R M‑O‑CO‑Ph M‑CHO et M‑CO‑R M‑CO‑Ph M‑CO‑OH et M‑CO‑OR M‑CO‑NR2 M‑CºN M‑NH2 et M‑NR2 M‑N+R3 M‑NH‑CO‑R M‑NO2 M‑SH et M‑SR |
0,8-1,6 1,6-2,0 1,7-2,8 2,2-2,8 4,2-4,8 3,0-4,0 3,4-4,1 3,1-4,2 3,2-3,6 3,8-4,6 3,6-5,0 3,8-5,0 2,1-2,6 3,8-5,0 1,8-2,6 1,8-2,2 2,2-3,0 2,2-3,0 3,0-3,6 3,0-3,8 4,1-4,4 2,1-5,1 |
M‑C‑CH2R M‑C‑C=C M‑C‑CºC M‑C‑Ph M‑C‑F M‑C‑Cl M‑C‑Br M‑C‑I M‑C‑OH
et M‑C‑OR M‑C‑OPh M‑C‑O‑CO‑R M‑C‑O‑CO‑Ph M‑C‑CHO M‑C‑CO‑R M‑C‑CO‑Ph M‑C‑CO‑OR M‑C‑CO‑NR2 M‑C‑CºN M‑C‑N+R3 M‑C‑NH‑CO‑R M‑C‑NO2 M‑C‑SH
et M‑C‑SR |
0,9-1,6 1,0-1,8 1,2-1,8 1,1-1,8 1,5-2,2 1,5-2,0 1,8-1,9 1,7-2,1 1,2-1,8 1,3-2,0 1,3-1,8 1,6-2,0 1,1-1,7 1,1-1,8 1,1-1,9 1,1-1,9 1,1-1,8 1,2-2,0 1,4-2,0 1,1-1,9 1,6-2,5 1,3-1,9 |
Domaines de déplacements chimiques de divers protons.
|
type de proton |
d en ppm |
type de proton |
d en ppm |
|
>C(cycle)=CH2 >C=CH2 ‑C=CH‑ ‑C=CH‑ (cyclique) R‑CºC‑H Ar‑H >C=CH‑CO‑ ‑CH=C‑CO‑ R‑CHO Ar‑CHO H‑CO‑O‑ H‑CO‑N< |
4,6 5,3 5,1 5,3 3,1 7,0-9,0 5,9 6,8 9,9 9,9 8,0 8,0 |
‑CO‑OH >C=C‑OH PhH R‑OH Ar‑OH Ar‑OH (avec liaison H intramoléculaire) R‑NH‑ Ar‑NH R‑CO‑NH‑ CHCl3 H2O |
8,5-13 11-17 7,2 0,5-5,5 4,0-7,5 5,5-12,5 0,5-3,0 3,0-5,0 5,0-8,5 7,2 »5,0 |
N° de poste :
Première étape : oxydation de la
benzoïne en benzile par l’acétate de cuivre (II).
|
Temps de reflux suffisant pour la synthèse |
|
|
Masse de benzile brut humide |
m1 = |
|
Masse de benzile brut sec |
m2 = |
|
Rendement en benzile brut (R1) |
|
|
Aspect du benzile |
|
|
Température de fusion |
|
Deuxième étape : synthèse de la
phénantoïne à partir du benzile.
|
Masse de phénantoïne brute humide |
m3 = |
|
Masse
de phénantoïne brute humide mise à l’étuve |
m4 = |
|
Masse
de produit brut sec |
m5 = |
|
Masse
de produit brut humide mis à recristalliser |
m6 = |
|
Masse
de produit purifié sec |
m7 = |
|
Aspect
de la phénantoïne purifiée |
|
|
Rendement
en phénantoïne brute (R2) |
|
|
Rendement
de recristallisation (R3) |
|
|
Rendement
en phénantoïne pure (R4) |
|



