DOSAGE DE L'ACIDE ACETYLSALICYLIQUE DANS L'ASPIRINE.
1) Objectif
Mesurer la quantité d'acide acétylsalicylique contenue dans
500mg d'aspirine préparée au laboratoire.
En déduire le pourcentage de pureté de cette préparation.
2) Eléments théoriques
nécessaires à la compréhension du dosage.
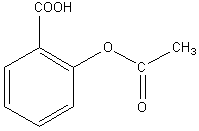
La formule semi-développée de l'acide acétylsalicylique fait
apparaître :
Une fonction acide carboxylique,
Une fonction ester.
Le dosage d'une fonction acide peut être réalisé de façon
classique par une base forte.
Le dosage direct de la fonction ester ne se fait pas.
Une méthode consiste à saponifier la fonction ester par un
excès de soude (simultanément la fonction acide est attaquée) et à doser
l’excès de soude par un acide fort. Cette méthode porte le nom de dosage
indirect ou de dosage en retour.
Cette deuxième méthode est plus précise que le dosage direct
car l'aspirine est peu soluble dans l'eau à froid alors que la réaction de
saponification est une réaction totale, rapide, qui à chaud, favorise la
dissolution du comprimé.
3) Manipulation.
3-1) Préparation du
dosage : saponification de la fonction ester et réaction de la fonction
acide.
Dans un erlenmeyer de 100mL
introduire 500mg d'aspirine préparée et purifiée lors de la synthèse
précédente, 10,0mL d’une solution d'hydroxyde de sodium de concentration
0,700mol.L-1 et environ 10mL
d'eau distillée.
Porter le mélange à une température comprise entre 60
et 70°C pendant quelques minutes.
Laisser refroidir. Ajouter quelques gouttes de bleu de
bromothymol.
3-2) Dosage.
Doser l'excès d'hydroxyde de sodium par une solution
d'acide chlorhydrique à 0,100mol.L-1.
Noter le volume d'acide versé à l'équivalence acido-basique.
4) Exploitation des résultats
expérimentaux.
Ecrire l'équation de réaction qui a lieu dans la
première phase entre l'acide acétylsalicylique et la solution d'hydroxyde de
sodium.
Calculer la quantité d'hydroxyde de sodium
initialement introduite.
A partir du volume d'acide chlorhydrique versé à
l'équivalence acido-basique, calculer la quantité d'ions hydroxyde qui reste
après la première phase.
En déduire la quantité d'ions hydroxyde consommée par
la première phase, et la quantité d'acide acétylsalicylique présente dans
l'échantillon dosé.
Calculer la quantité d'acide acétylsalicylique
théoriquement présente dans 500mg d'aspirine pure. En déduire le pourcentage de
pureté de l'aspirine préparée.
Données :
Aspirine ou acide acétylsalicylique ou acide acétoxy-2 benzoïque
Formule brute : C9H8O4
Formule semi-developpée
: 
Masse molaire moléculaire : 180,2 g.mol-1 Température de fusion : 143°C
Poudre cristalline blanche, peu soluble dans l’eau, soluble dans l’alcool et dans l’éther.