ACYLATION DU FERROCENE
1) Présentation
:
Le ferrocène A est un complexe métallocène
dans lequel un ion fer(II) est inséré entre deux anions cyclopentadiènyle B disposés dans deux plans parallèles :
A
B
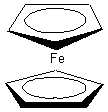
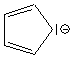
Les deux cycles, plans et conjugués, possèdent six électrons p délocalisés. Ils sont donc aromatiques et peuvent par conséquent donner lieu à des réactions de substitution électrophile aromatique.
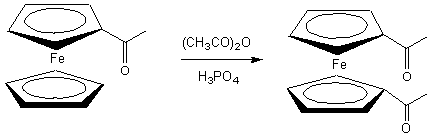
Si l’acylation du benzène, selon la
méthode de Friedel et Crafts, requiert l’utilisation
du chlorure d’aluminium comme catalyseur, le ferrocène
peut être acylé selon des conditions beaucoup plus douces avec l’emploi d’acide
phosphorique comme catalyseur ; on obtient alors l’acétylferrocène
C.
A
C

Comme le groupe acétyle est
désactivant, l’addition d’un second groupe acétyle ne peut pratiquement se
produire que sur le cycle cyclopentadiényle non
acétylé pour donner le 1,1’ diacétylferrocène D.
C
D
2) Données physico-chimiques et sécurité :
|
Produits |
Données
physico-chimiques |
Sécurité |
|
Ferrocène |
M
= 186,04 g.mol-1 |
|
|
Acide
phosphorique |
M = 98,00 g.mol-1 |
|
|
Anhydride
acétique |
M
= 102,09 g.mol-1 |
|
|
Cyclohexane |
M
= 84,16 g.mol-1 |
|
|
Acétylferrocène |
M
= 228 g.mol-1 |
|
|
Dichlorométhane |
d = 1,32 |
|
Phrases de risques et de sécurité données en annexe
3) Mode opératoire :
3-1) Synthèse de l’acétylferrocène
• Préparer un montage réactionnel composé d’un réacteur de 250 mL équipé d’une ampoule de coulée, d’un thermomètre et d’un
réfrigérant à reflux surmonté d’une garde à chlorure de calcium. La verrerie
doit être parfaitement sèche.
• Introduire 3,0 g de ferrocène puis ajouter 10 mL d’anhydride acétique et, avec précaution, 1,5 mL d’acide phosphorique à 85 % en masse tout en assurant
une agitation efficace.
• Chauffer au bain-marie (q = 60 °C)
sous forte agitation pendant 20 minutes. Attention, ne pas dépasser 60 °C car
alors on observerait la formation du produit diacétylé.
3-2) Isolement du produit brut
• Retirer le bain-marie puis ajouter, avec précaution, 50 g de glace pilée au
milieu réactionnel.
• Introduire ensuite 20 mL d’éthanol et 30 mL d’eau au contenu du réacteur.
• Chauffer à nouveau au bain-marie jusqu’à ce que la température du milieu
réactionnel atteigne 60 °C (attention à ne pas dépasser 80 °C), filtrer alors
immédiatement sur filtre plissé. Pendant toute la filtration maintenir la
température du milieu réactionnel à une température environ égale à 60 °C. Pour
cela, placer au préalable un entonnoir en verre à l’étuve (température de
l’étuve : 150 °C)
• Refroidir l’erlenmeyer contenant le filtrat
précédemment obtenu, y introduire 30 mL de dichlorométhane et agiter vigoureusement le mélange biphasique.
• Séparer la phase organique et la phase aqueuse.
• Procéder à deux extractions du contenu de la phase aqueuse avec deux volumes
de dichlorométhane égaux à 30 mL
• Les phases organiques sont réunies puis lavées une première fois avec 30 mL d’eau, une deuxième fois avec 30 mL
d’une solution d’hydrogénocarbonate de potassium à 10 % et une troisième fois
avec 30 mL d’eau.
• Sécher la phase organique à l’aide de sulfate de magnésium anhydre.
• Eliminer le solvant à l’aide de l’évaporateur rotatif ; refroidir le ballon
dans un bain de glace, le produit brut cristallise spontanément.
• Peser la masse de produit brut obtenu.
• Réserver quelques cristaux pour la chromatographie.
3-3) Purification du produit brut
• Recristalliser le produit brut dans le cyclohexane.
3-4) Analyse du produit purifié
• Par chromatographie sur couche mince (C.C.M) :
- dissoudre dans du dichlorométhane les
produits suivants : produit brut, produit purifié, ferrocène
commercial, acétylferrocène de référence
- éluant : cyclohexane/acétate d’éthyle (90/10)
• Par mesure de la température de fusion
4) Questions
4-1) Synthèse et purification de l’acétylferrocène
4-1-1) Donner le schéma de Lewis de l’électrophile se substituant sur le ferrocène.
4-1-2) Qu’aurait-on pu utiliser à la place de l’anhydride acétique pour obtenir
le même produit ?
4-1-3) Préciser le rôle de l’acide phosphorique.
4-1-4) Indiquer l’intérêt que présente l’utilisation d’une garde à chlorure de
calcium et écrire l’équation de la réaction susceptible de se produire en
l’absence de ce dispositif.
4-1-5) Préciser le rôle de l’ajout du mélange eau-éthanol en fin de réaction,
ainsi que celui de la filtration à chaud.
4-1-6) Quel est le but de l’extraction au dichlorométhane
?
4-1-7) Quel est le rôle du lavage avec la solution d’hydrogénocarbonate
de potassium ? Quelles réactions se produisent lors de ce lavage ?
4-2) Rendement de la synthèse
Calculer la valeur du rendement de la préparation.
4-3) Chromatographie sur couche mince
4-3-1) Quel est, du ferrocène et de l’acétylferrocène, le composé le plus polaire ? Justifier
votre la réponse à l’aide de l’observation de la plaque CCM après
élution et de l’analyse de la structure de ces deux molécules.
4-3-2) Interpréter la plaque C.C.M après élution.
4-4) Recristallisation
4-4-1) Donner le principe d’une recristallisation.
4-4-2) Expliquer comment, dans le protocole mis en œuvre, elle
permet de purifier l’acétylferrocène.
4-5) Contrôle de la pureté du produit
4-5-1) Repérer la bande caractéristique qui permet en spectroscopie I.R.
d’identifier le produit de réaction.
4-5-2) Que peut-on en conclure lorsque la mesure d’une température de
fusion différente de la valeur tabulée ?
5) Annexes
Annexe 1 : feuille de résultats
Annexe 2 : spectre IR de l’acétylferrocène
Annexe 3 : table de spectroscopie IR
Feuille de résultats :
• Masse de produit pur sec :
• Rendement de la préparation :
• Température de fusion mesurée :
• Plaque CCM obtenue :
Annexe 2 : spectre IR de l’acétylferrocène
Annexe 3 : Table de spectroscopie IR
Table des nombres d’onde des vibrations de valence et de déformation.



