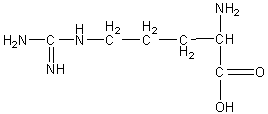DOSAGES pHMETRIQUES
D'ACIDES AMINES
Le dosage
pH-métrique d'un acide aminé permet de calculer sa concentration molaire en
soluté apporté et de retrouver les valeurs des pKa
caractéristiques de la solution titrée.
L'étude des graphes pH=f(Vacide ou base) permet, en utilisant la
méthode des tangentes, de repérer les points d'équivalence et d'en déduire les
caractéristiques des solutions.
1) Données :
|
Acides aminés |
Formules |
pKa1 |
pKa2 |
pKar |
pHi |
|
Glycine |
|
2,34 |
9,6 |
|
5,97 |
|
Arginine |
|
2,17 |
9,04 |
12,48 |
10,76 |
|
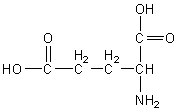
Acide glutamique |
|
2,2 |
9,7 |
4,4 |
3,22 |
- Toutes les solutions titrantes et titrées ont une concentration molaire en
soluté apporté de 0,100 mol.L-1.
- La concentration molaire des solutions titrantes d'acide
chlorhydrique et d'hydroxyde de sodium sont données
CHCl = (0,……+
ou -……) mol.L-1 CNaOH = (0,……+
ou - ……) mol.L-1.
Les valeurs ont été calculées après des étalonnages par pesée.
- Le dosage des acides aminés peut être effectué en solution aqueuse ou dans un
mélange eau méthanal. Dans ce dernier cas, l'exploitation des valeurs du pH à
la demi équivalence ne permet pas de retrouver les
valeurs des pKa.
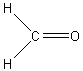
- Le méthanal (H2CO) porte
encore le nom de formol ou méthaldéhyde ; sa formule
semi développée peut s'écrire :
Les consignes de risque et de sécurité relatives à ce composé sont :
R : 23/24/25-34-40-43 et S : 36/37/39-45-51.
Avant toute manipulation il est impératif de rechercher la signification de ces
phrases de risque.
2) Eléments théoriques relatifs
au couple acide/base
Couple acide/base : HA/A- :
HA + H2O
= H3O+
+ A- .
La loi d’action de masse traduisant cet équilibre chimique s’écrit :
.
Cette constante Ka porte le nom de constante d'acidité du couple
considéré. On définit également la grandeur pKa
= -log Ka.
- Dans le cas des acides aminés la présence des fonctions acide
carboxylique et amine primaire sur la même molécule entraînent
obligatoirement l'existence de deux couples d'où les deux pKa.
- De plus, parfois, la présence d'un autre couple acide/base sur la chaîne
latérale conduit à donner une autre valeur le pKr.
Une formulation différente de la constante d'acidité permet de faire apparaître
plus clairement les domaines de prédominance de la forme acide HA du couple ou
de la forme basique A- de ce couple. C'est la forme
logarithmique traduite par la relation d’Henderson :
.
La connaissance du pH du milieu réactionnel permet de prévoir les espèces
prédominantes des différentes formes de l'acide aminé.
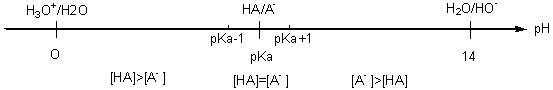
Domaines de prédominance :
• Si pH<pKa alors : [HA] >[A-]
• Si pH=pKa alors : [A-] = [HA]
• Si pH>pKa alors : [A-] > [HA]
Espèces majoritaires, minoritaires, ultra minoritaires :
- Espèce majoritaire : C'est celle dont la concentration est supérieure ou
égale à dix fois celle de l'espèce minoritaire.
- Espèce minoritaire : C'est celle dont la concentration est inférieure ou
égale au dixième de celle de l'espèce majoritaire et supérieure ou égale à dix
fois celle de l'espèce ultra minoritaire.
- Espèce ultra minoritaire : C'est celle dont la concentration est inférieure
ou égale au dixième de celle de l'espèce minoritaire.
Les limites de séparation des espèces majoritaire et minoritaire sont données
par pKa + ou - 1.
Dans les bilans de matière ou de charge on négligera les
espèces minoritaires et ultra minoritaires par rapport aux espèces
majoritaires. Cela permettra de considérer que certaines réactions sont
prépondérantes.
3) Etude expérimentale
3-1) Montage expérimental :
Les volumes versés à la burette graduée seront choisis pour obtenir la
meilleure précision possible dans la zone du point d'équivalence.
Il est conseillé de verser des volumes par fractions de 0,5mL dans les zones
éloignées du point d'équivalence et par fractions de 0,2 mL
autour du point d'équivalence.
pH-mètre : c'est un
millivoltmètre.
Il mesure la différence de potentiel entre deux points du circuit. Ici entre
deux électrodes.
Electrode de référence : son potentiel doit être insensible à la
variation de concentration en ion oxonium.
Electrode de mesure ou indicatrice : son potentiel doit suivre
les variations de concentration en ion oxonium.
3-2) Manipulation
: dosages pH-métriques
3-2-1) Dosage de la glycine
a) En solution aqueuse
• Réaliser le dosage d'une prise d'essai de 10,0 mL
de glycine à environ 0,100 mol.L-1 additionnée de 60 mL
d'eau distillée par une solution de soude à environ 0,100 mol.L-1
(la concentration exacte est notée sur le flacon).
Tracer la courbe pH = f(Vb
versé).
b) En présence de méthanal
Remarque : compte tenu du pH à l'équivalence les mesures précédentes
manquent de précision (pH voisin de 10,6). Pour surmonter cette difficulté on
transforme la fonction amine pour abaisser son pKa ;
pour cela on travaille en présence un excès de méthanal qui se fixe sur le
groupe -NH3+.
• Préparer un mélange de 10mL de méthanal
à 40% et de 50 mL d'eau distillée.
• Ajuster le pH de cette solution à pH~ 6 avec quelques gouttes de soude
à 0,01mol.L-1.
• Ajouter la prise d'essai de 10,0 mL de glycine
à environ 0,10 mol.L-1
• Réaliser le dosage par une solution de soude à environ 0,100 mol.L-1
(la concentration exacte est notée sur le flacon).
• Tracer sur le même graphique que la courbe précédente : pH’ = f(Vb versé)
3-2-2) Dosage de l'acide glutamique
• Réaliser le dosage d'une prise d'essai de 20,0mL d'acide glutamique à
environ 0,050 mol.L-1 additionnée de 60 mL d'eau distillée par une solution de soude à
environ 0,100mol.L-1 (la concentration exacte est notée sur le
flacon).
• Tracer la courbe pH = f(Vb versé)
3-2-3) Dosage de l'arginine
• Réaliser le dosage d'une prise d'essai de 10,0mL d'arginine à environ
0,10 mol.L-1 additionnée de 60 mL d'eau distillée par une solution d'acide chlorhydrique à
environ 0,100 mol.L-1 (la
concentration exacte est notée sur le flacon).
• Tracer la courbe pH = f(Vb
versé)
3-3) Exploitation
des résultats expérimentaux
• Dans les trois cas, analyser la courbe :
- déterminer les volumes équivalents aux équivalences ;
- déterminer les pH aux demi équivalences.
• Dans les trois cas, calculer
les concentrations des acides aminés dosés.
• Identifier les espèces chimiques présentes et vérifier que l'on retrouve
bien les valeurs des pKa du tableau initial.
4) Interprétation
Proposer une équation de réaction permettant de modéliser la transformation de
la glycine en présence de méthanal.