SYNTHESE DU ZYBAN
Chlorure de (±)-2-(t-butyl-ammonium)-3’-chloropropiophénone
|
|
Depuis le
1er février 2007, il est interdit de fumer dans tous les lieux
publics suite à la prise de conscience des nombreuses conséquences néfastes
du tabagisme y compris passif sur la santé. Pour aider au sevrage tabagique,
l’industrie pharmaceutique a développé toute une gamme de médicaments. La
nicotine, présente dans les cigarettes, est le principal responsable de la
dépendance au tabac. Elle est classée parmi les substances psychotropes en
tant que stimulant du système nerveux central. La fumée de cigarette est un
aérosol composé de particules solides dispersées dans une phase gazeuse. Elle
contient plus de 4000 composés chimiques dont des métaux lourds et des
pesticides toxiques. Plus de 50 de ces substances sont des carcinogènes
(c’est-à-dire qu’elles peuvent provoquer le développement d’un cancer). Ils
proviennent, pour moitié, de la feuille de tabac vert. Le reste apparaît
pendant le procédé de séchage ou est ajouté par les fabricants pour rehausser
l’arôme ou atténuer l’irritation de la gorge et des voies respiratoires
(édulcorant, menthol…). Une partie importante est créée par réaction chimique
lors de la combustion du tabac. FUMER NUIT
GRAVEMENT A VOTRE SANTE ET A CELLE DE VOTRE ENTOURAGE |
|
Composition
de la phase gazeuse de la fumée |
Type de
toxicité |
Quantité
dans le courant principal /cigarette |
|
Monoxyde
de carbone |
Toxique |
26,8 - 61
mg |
|
Benzène |
Cancérogène |
1500 µg |
|
3-vinylpyridine |
Suspect
cancérigène |
300 – 450
µg |
|
Cyanure
d’hydrogène |
Toxique |
14 – 110 ng |
|
Hydrazine |
Suspect
cancérigène |
90 ng |
|
Oxydes
d’azote (NOx) |
Toxique |
500 – 2000
µg |
|
N-nitrosodiméthylamine |
Suspect
cancérigène |
200 – 1040
µg |
|
N-nitrosopyrrolidine |
Suspect
cancérigène |
30 – 390 ng |
Le chlorure
de (±)-2-(t-butyl-ammonium)-3’-chloropropiophénone
est le principe actif du Zyban, médicament prescrit
pour aider les fumeurs à arrêter de fumer.
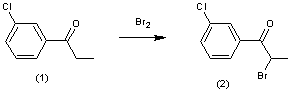
On se propose de synthétiser ce principe actif, noté (3) à partir du métachloropropiophénone, noté (1). La transformation
s’effectue suivant deux réactions :
* 1ère réaction : bromation de la métachloropropiophénone
(1) :
|
|
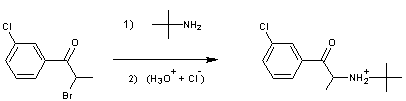
* 2ère réaction : réaction de
substitution de la 2-bromo-1-(3-chlorophenyl)propan-1-one, notée (2),
par la t-butylamine suivie d’une acidification
(permettant d’obtenir le chlorure d’ammonium et non l’amine secondaire) :
|
|
Les deux réactions s’effectuent dans le
même milieu réactionnel, l’une à la suite de l’autre.
1)
Mode opératoire :
1-1) Avertissement :
Les vapeurs de dibrome étant extrêmement toxiques :
·
toute trace de dibrome devra être neutralisée par une solution d’hydroxyde
de sodium à 20 %.
·
toutes les manipulations se
feront sous la hotte.
1-2) Bromation
de la métachloropropiophénone (1) :
·
Placer
·
Équiper le ballon d’une ampoule de coulée isobare bouchée
et d’un réfrigérant à boules surmonté d’un piège à vapeurs selon le montage
suivant (la solution de neutralisation sera une solution de soude à 20 %) :
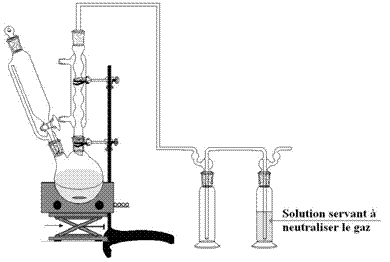
·
Introduire un barreau aimanté dans le ballon bicol puis mettre sous agitation magnétique.
·
Introduire 12,0 mL d’une solution
de dibrome dans le dichlorométhane
(de concentration molaire 1,0 mol.L-1)
dans l’ampoule de coulée isobare.
·
Tout en agitant, ajouter quelques gouttes de
solution de dibrome dans le ballon. Une décoloration
de la solution doit être observée. Si cela ne se produit pas, chauffer le
ballon avec un sèche-cheveux. Si aucun changement de couleur ne se produit,
ajouter rapidement quelques gouttes d’acide chlorhydrique concentré dans le
ballon.
·
Une fois la décoloration observée, ajouter goutte à goutte
la solution de dibrome. Régler le débit de
telle sorte à ce que la solution se décolore avant l’ajout suivant.
·
Lorsque l’addition est terminée, retirer l’ampoule de
coulée isobare et transformer le montage de manière à effectuer une
distillation simple.
Attention : des vapeurs acides peuvent se
dégager du ballon réactionnel ; Neutraliser les traces de dibrome
encore présentes dans l’ampoule de coulée isobare.
·
Placer la calotte chauffante sur l’agitateur
magnétique puis éliminer le solvant en réglant la sonde de température à
Appeler un
membre du jury pour le réglage de la sonde.
·
Lorsque la distillation est terminée, revenir à
température ambiante. Le ballon contient alors le dérivé bromé (2) qui
est utilisé dans la prochaine étape.
1-3 Obtention du principe
actif (3) :
·
Retirer les éléments constituants le montage de
distillation simple et ne conserver que le ballon contenant le produit (2).
·
Introduire un mélange de 10 mL
de t-butylamine et de 10 mL
de N-méthylpyrrolidinone (NMP) dans le ballon.
·
Porter le mélange réactionnel à reflux, sous agitation
vigoureuse durant 20 minutes (la sonde de température du système
chauffant doit être réglée à
·
Refroidir dans un bain de glace.
·
Transférer ensuite le mélange réactionnel dans une
ampoule à décanter. Ajouter 50 mL d’eau, puis
procéder à trois extractions avec 30 mL d’éther diéthylique.
·
Réunir les phases organiques. Procéder alors à trois
lavages avec 25 mL d’eau.
·
Sécher la phase organique au carbonate de sodium
anhydre.
·
Recueillir la phase organique dans un grand bécher
préalablement plongé dans un cristallisoir rempli de glace.
·
Ajouter goutte à goutte, tout en maintenant une
agitation magnétique, un mélange 20/100 en volume d’acide chlorhydrique
concentré et d’alcool isopropylique jusqu’à obtenir
un pH inférieur à 3.
·
Filtrer sur verre fritté le solide obtenu puis le
laver avec un minimum d’éther diéthylique.
·
Sécher à l’étuve (
·
Réaliser une chromatographie sur couche mince. On
réalisera les dépôts des espèces suivantes en solution à 1 % dans l’acétone :
* métachloropropiophénone
commercial (1) (fournie)
* produit synthétisé (à préparer).
L’éluant est
un mélange CH2Cl2 / CH3OH (19 / 1 en volume).
La révélation sera effectuée sous radiation UV à 254 nm.
·
Préparer 5 mg de produit synthétisé dans un pilulier.
Appeler le jury pour qu’il procède à une analyse de pureté HPLC. Stocker le reste
de produit synthétisé dans une boîte de pétri sur laquelle figureront nom et
numéro de poste.
2)
Données
Les températures de changement d’état sont données sous pression
atmosphérique normale.
Significations des phrases R et S
|
Produit |
Données physiques |
Risques et sécurité |
|
|
m-chloro propiophénone (1) |
M = Tfus = 45 - |
|
|
|
Chlorure de (±)-2-(t-butyl-ammonium)-3’-chloropropio-phénone (3) |
M = Peu
soluble dans le mélange HClconc /alcool isopropylique pKA ≈ 8 |
|
|
|
Dichlorométhane |
M = d = 1,32 Teb = 39 – nD20 = 1,4240 |
|
|
|
Solution de soude |
20 % en
masse |
|
|
|
Dibrome |
M = d = 3,11 |
|
|
|
Acide chlorhydrique concentré |
M = 37 % en
masse d = 1,18 |
|
|
|
t-butylamine |
M = Teb = d = 0,69 |
|
|
|
N-méthylpyrrolidinone
(NMP) |
M = Teb = d = 1,03 |
|
|
|
Éther diéthylique |
Teb = d = 0,714 |
|
|
|
Alcool isopropylique |
M = Teb = 81 – d = 0,78 |
|
|
|
Acétone (propanone) |
M = Teb = d = 0,78 |
|
|
|
Méthanol |
M = Teb = d = 0,79 |
|
3)
Questions
3-1) Calcul du rendement
Le composé (1)
sera noté sous la forme Ar—CO—CH2—CH3. L’équation de la
réaction de bromation s’écrit :
Ar—CO—CH2—CH3 + Br2 = Ar—CO—CHBr—CH3
+ HBr
Q1 : Calculer la
quantité de matière attendue en composé bromé (2) formé dans le milieu réactionnel. On pourra utiliser les abréviations
(1) et (2) pour désigner les espèces chimiques intervenant dans l’équation de
la réaction.
Q2 : Écrire
l’équation de la réaction qui s’effectue dans l’étape 1) de la deuxième
réaction (réaction avec la t-butylamine).
Q3 : Déterminer
une relation entre la quantité de matière en composé bromé (2) et en composé final (3). Justifier la réponse.
Q4 : Calculer la masse de composé final
(3) attendue. En déduire le rendement R de la réaction.
3-2) Obtention de la 2-bromo-1-(3-chlorophenyl)propan-1-one
(2)
Q5 : Justifier
l’emploi d’un piège à gaz en identifiant la (les) espèce(s) chimique(s) qui est
(sont) susceptible(s) de s’échapper du milieu réactionnel.
Q6 : Faire un
bilan des espèces présentes dans le milieu réactionnel à la fin de la première
étape (avant la distillation simple). Justifier très brièvement la présence de
ces espèces dans le milieu réactionnel.
Q7 : Indiquer
le(s) espèce(s) retirée(s) du milieu réactionnel par distillation simple.
3-3) Obtention du principe actif (3)
Q8 : Préciser l’objectif
visé lorsque l’on traite la phase aqueuse avec de l’éther diéthylique.
Indiquer les espèces retirées de la phase aqueuse.
Q9 : Pourquoi le
pH de la solution doit-il être inférieur à 3 lors de la formation du solide (3)
?
4) Analyse des produits
Q10 : Interpréter
le spectre I.R. de la métachloropropiophénone (1) donné en annexe (repérer les bandes
caractéristiques de la molécule).
Q11 : Quelles
bandes caractéristiques du principe actif (3) doit-on trouver sur son spectre
I.R. ?
Q12 : Sur la
plaque C.C.M. réalisée, peut-on s’apercevoir de la présence de t-butylamine ? Justifier la réponse.
Q13 : Interpréter
la plaque C.C.M. obtenue (le calcul des rapports frontaux n’est pas
obligatoire).
Q14 : La HPLC
est une technique chromatographique analogue à celle de la CCM : les
constituants d’un mélange, entrainés par un éluant vont migrer le long d’une
phase stationnaire, contenue dans une colonne, à des vitesses différentes, ce
qui va conduire à leur séparation. Un détecteur permet d’analyser les
constituants à la sortie de la colonne. On mesure TR, le temps de
rétention qui est le temps écoulé entre l’instant où l’échantillon est injecté
et celui où le pic correspondant au constituant a atteint sa valeur maximale.
Voici les TR
de deux espèces chimiques :
|
métachloropropiophénone (1) |
TR
= 3,0-3,1 min |
|
(±)-2-(t-butyl-ammonuim)-3’-chloropropiophénone
(3) |
TR
= 2,1-2,2 min |
Au vu du chromatogramme
HPLC obtenu à partir de votre solide, peut-on affirmer que le produit
synthétisé (3) est le bon et qu’il est pur ? Justifier correctement la réponse.
Q15 : Comparer
les deux techniques chromatographiques CCM et HPLC.
5) Rejets des solutions :
Q16 : Indiquer où
l’on doit jeter les solutions suivantes :
* soude ayant servi à neutraliser le
dibrome ;
* distillat issu de la distillation
simple ;
* filtrat issu de la filtration sur
verre fritté.
SPECTROSCOPIE INFRAROUGE
Spectre I.R.
de la métachloropropiophénone (1)
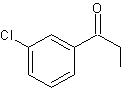

|
Nb d’onde (cm-1) |
Transmittance (%) |
Nb d’onde (cm-1) |
Transmittance (%) |
Nb d’onde (cm-1) |
Transmittance (%) |
|
3066 |
87 |
1421 |
60 |
904 |
86 |
|
2925 |
7 |
1377 |
48 |
782 |
55 |
|
2854 |
15 |
1214 |
37 |
724 |
82 |
|
1697 |
36 |
1075 |
76 |
699 |
80 |
|
1574 |
71 |
1023 |
85 |
681 |
66 |
|
1459 |
34 |
961 |
77 |
Table des nombres
d’onde des vibrations de valence et de déformation.
F: fort ; m:
moyen ; f: faible
|
Liaison |
Espèce |
Nature des
vibrations |
Nombre
d’onde cm-1 |
Intensité |
|
O-H |
Alcool
libre |
Valence |
3590-3650 |
F ; fine |
|
O-H |
Alcool lié |
Valence |
3200-3600 |
F ; large |
|
N-H 2
bandes |
Amine
primaire |
Valence |
3300-3500 |
m |
|
N-H 1
bande |
Amine
secondaire |
Valence |
||
|
Cdi-H |
Alcyne |
Valence |
environ
3300 |
m ou f |
|
Ctri-H |
Alcène |
Valence |
3030-3100 |
m |
|
Ctri-H |
Aromatique |
Valence |
3000-3100 |
m |
|
Ctet-H |
Alcane |
Valence |
2850-3000 |
F |
|
Ctri-H |
Aldéhyde |
Valence |
2700-2900 |
m (2
bandes) |
|
OH |
Acide
carboxylique |
Valence |
2500-3200 |
F à m ;
large |
|
|
Alcyne |
Valence |
2100-2260 |
f |
|
C=O |
Aldéhyde
et cétone |
Valence |
1650-1730 |
F |
|
C=O |
Acide
carboxylique |
Valence |
1725-1700 |
F |
|
C=C |
Alcène |
Valence |
1620-1690 |
m |
|
C=C |
Aromatique |
Valence |
1450-1600 |
Variable ;
|
|
N-H amine |
Amine |
Déformation |
1560-1640 |
F ou m |
|
Ctet-H |
Alcane |
Déformation |
1430-1480 |
F |
|
Ctet-H (CH3) |
Alcane |
Déformation |
1370-1390 |
F ; 2
bandes |
|
Ctet-O |
Alcool |
Valence |
1010-1200 |
F |
|
Ctet-N |
Amine |
Valence |
1020-1250 |
m |
|
Ctri-H de -HC=CH- (E) |
Alcène |
Déformation |
960-970 |
F |
|
Ctri-H |
Aromatique
monosubstitué |
Déformation |
730-770 et
680-720 |
F ; 2
bandes |
|
Ctri-H |
Aromatique
1,2-disubstitué |
Déformation Déformation Déformation |
735-770 750-800 et
680-720 800-860 F |
F F et m ; 2
bandes |
Annexe 1 : Feuille de résultats à rendre avec la copie
Nom :……………… Prénom
:…………… Numéro :……………
Masse de produit (3) récupéré :
m =
→ Rendement en (3) R =
Fournir le chromatogramme H.P.L.C. effectué par le jury avec la feuille
de résultats.
Joindre la plaque C.C.M.