EXERCICE 107
Corrigé
Enoncé
Le phénaglycodol est le nom usuel d'un médicament
utilisé notamment contre l'épilepsie. Sa synthèse peut se faire selon la
séquence ci-dessous:
Données:
numéros atomiques:
Z(H) = 1 ; Z(C) = 6 ; Z(N) = 7 ; Z(O) = 8 ; Z(Cl) = 17.
1) Le chlorobenzène réagit avec le chlorure d'éthanoyle
de formule CH3-COCl pour donner du
chlorure d'hydrogène et un produit [A] de formule:
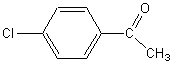
1-1) Ecrire l'équation de la réaction.
1-2) De quel type de réaction s'agit-il?
1-3) Quel est le catalyseur usuellement employé?
1-4) Quels sont les isomères de position du produit [A]
que l'on aurait pu obtenir?
2) [A] est traité par de l'acide cyanhydrique HCN ; on obtient un composé
[B] de formule brute C9H8NOCl.
2-1) Ecrire l'équation de la réaction en faisant
apparaître les formules semi-développées des molécules organiques mises en jeu.
2-2) Quelles sont les fonctions organiques présentes dans
la molécule [B] ?
2-3) De quel type de réaction s'agit-il?
3) L'hydrolyse du composé [B] conduit à la formation d'un acide carboxylique [C], dont la formule brute est C9H9O3Cl. Donner la formule semi-développée de [C].
4) Le composé [C] réagit avec l'éthanol pour donner le composé [D].
4-1) Ecrire l'équation de la réaction sous forme
semi-développée.
4-2) Quel est le nom de cette réaction?
5) Le composé [D] est traité par un large excès de CH3MgBr.
Après hydrolyse, on obtient le phénaglycodol [E] de
formule :
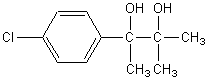
5-1) A quelle famille de composés appartient CH3MgBr
?
5-2) Combien peut-il exister de stéréoisomères
du phénaglycodol [E] ? Justifier la réponse.
5-3) Donner la représentation de Cram
d'un des stéréoisomères du phénaglycodol
en précisant la configuration absolue du (ou des) atome(s) de carbone
asymétrique(s). Justifier la réponse.
Corrigé
1) Première étape de la fabrication du phénaglycodol
: formation de [A]
1-1)
1-2) Type de réaction : substitution
électrophile ; réaction d’acylation.
Remarque : orientation de la substitution, L’atome de chlore
électronégatif a un caractère attracteur et défavorise la seconde substitution
mais il oriente tout de même en ortho (1,2) et para (1,4).
1-3) Le catalyseur usuellement
employé est le chlorure d’aluminium(III) AlCl3.
1-4) Deux autres isomères de
position sont envisageables :
L’isomère ortho (1,2) et l’isomère méta (1,3).
2) Traitement de [A] par l’acide cyanhydrique
HCN, c’est le groupe C=O (fonction cétone) qui est le siège de la
transformation
2-1) 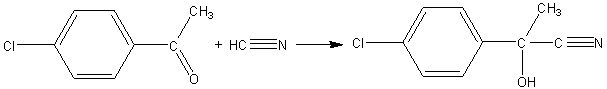
2-2) 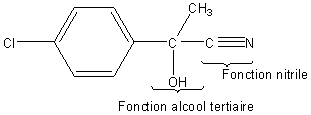
2-3) La réaction mise en jeu se fait sur la fonction cétone, il s’agit d’une réaction d’addition nucléophile sur le groupe C=O.
3) L’hydrolyse du nitrile entraîne la formation de l’acide
carboxylique [C] et la formation d’ammoniac.
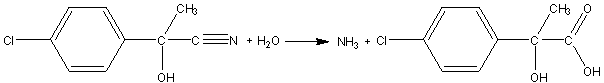
4) La réaction mise en jeu a lieu entre la fonction acide
de [C] et l’alcool.
4-1) 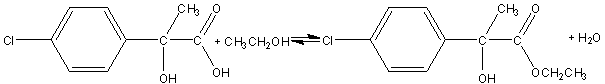
4-2) La réaction mise en jeu
correspond à une estérification.
5) CH3MgBr
appartient à la famille des organomagnésiens.
5-1) Le composé [E] formé présente
un seul carbone asymétrique il peut se présenter sous la forme de deux stéréoisomères différents. L’un correspond à la
configuration absolue (R) l’autre (S).
5-2) Les quatre groupements liés au
carbone asymétrique sont classés en respectant les règles de Cahn Ingold Prélog.
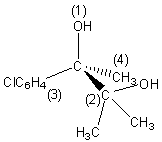
Le stéréoisomère représenté correspond à la configuration absolue (R)du phénaglycodol.