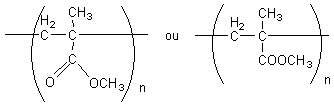EXERCICE 130
CORRIGE
1) De l'acide acétique à l'aspirine :
1-1) L'acide
acétique : structures et effets électroniques.
1-1-1) 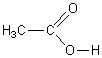 Acide éthanoïque
Acide éthanoïque
1-1-2)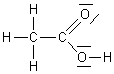 Le carbone du CH3
est sp3 (Quatre liaisons simples) ; l'autre est sp2 (Deux
liaisons simples et une double liaison).
Le carbone du CH3
est sp3 (Quatre liaisons simples) ; l'autre est sp2 (Deux
liaisons simples et une double liaison).
1-1-3)
Espèce basique conjuguée de l'acide acétique :
 La charge - est répartie sur trois atomes ; cette espèce est donc relativement stable.
La charge - est répartie sur trois atomes ; cette espèce est donc relativement stable.
Espèce basique conjuguée de l'éthanol :
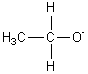 Rien de tel, cette espèce est donc moins stable que la précédente et la
molécule a donc moins tendance à donner un ion H+ (moins acide).
Rien de tel, cette espèce est donc moins stable que la précédente et la
molécule a donc moins tendance à donner un ion H+ (moins acide).
1-2) L'acide
acétique : réactivité
1-2-1)
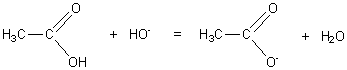
1-2-2)
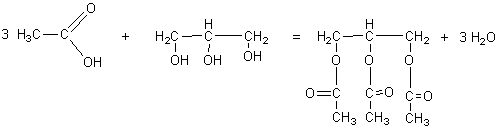
Il s'agit d'une estérification ; réaction lente, réversible, athermique.
1-2-3)
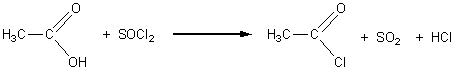
SO2 : dioxyde de soufre, c'est un réducteur ; HCl
: Chlorure d'hydrogène, sa solution est acide.
1-3) L'acide acétique :
solvant.
1-3-1) L'acide acétique est un solvant polaire et protique.
1-3-2) Un exemple :
1-3-2-1) Cette expérience permet de déterminer le nombre de doubles liaisons
que possède la molécule d'ester qui constitue l'huile (un corps gras est un
triester d'un acide gras avec le glycérol). On veut donc déterminer le degré d'insaturation de la chaîne carbonée de l'acide gras : c'est
l'indice d'iode.
1-3-2-2)
I2 + ICl3 = 3 ICl
1-3-2-3)
![]()
1-3-2-4) Dans l'eau la molécule d'ICl est détruite.
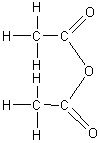
1-4) L'anhydride acétique :
1-4-1) Formation :
1-4-1-1)
|
Cétène |
Anhydride éthanoïque |
|
|
|
1-4-1-2) H2C=CH2 ; CH4
; CO.
1-4-2) Réactivité :
1-4-2-1) Vis-à-vis d'un alcool :
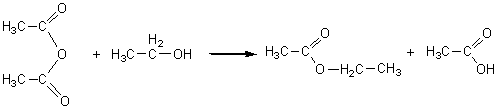
Réaction totale et rapide.
L'éthanol est le réactif nucléophile.
L'anhydride acétique est le réactif électrophile.
1-4-2-2) Vis-à-vis de la cellulose du bois :
Hydrophobe : qui n'a pas d'affinité avec l'eau
(repousse l'eau).
La réaction a lieu sur les fonctions alcool de la
cellulose.
1-4-2-3) Vis-à-vis d'un phénol :
Paracétamol :
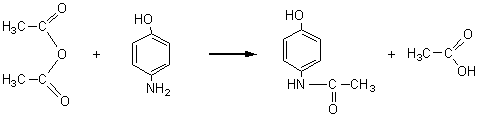
Aspirine :
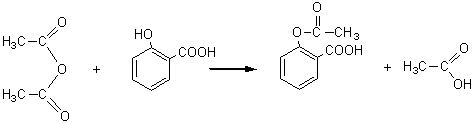
L'acylation a lieu sur la fonction amine du 4-aminophénol pour le paracétamol et sur la fonction phénol
de l'acide 2-hydroxybenzoïque pour l'aspirine.
La fonction amine est un meilleur réactif nucléophile
que la fonction phénol.
2) Les acides gras :
2-1) Généralités :
2-1-1)
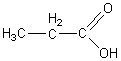
2-1-2)
2-1-2-1) a : nombre de carbones de la molécule.
2-1-2-2) b : nombre d'insaturations
carbone-carbone.
2-1-2-3) wx : position du
carbone portant la première insaturation, en partant
de l'extrémité de la chaîne carbonée, opposée à la fonction acide.(COOH).
2-2) Les
acides gras de l'huile de colza :
2-2-1)
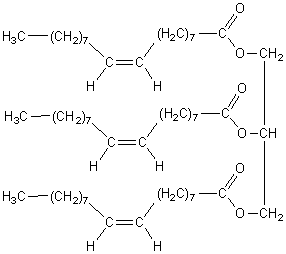
2-2-2)
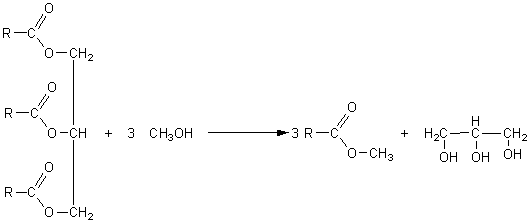
2-2-3) On utilise l'acide sulfurique concentré.
3) Quelques acides naturels importants :
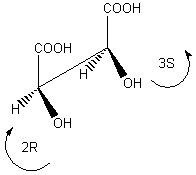
3-1) L'acide lactique :
3-1-1)
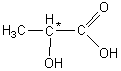
3-1-2) Acide 2-hydroxypropanoïque.
3-1-3)
3-1-3-1) Cette molécule est chirale, elle possède un carbone asymétrique.
3-1-3-2) Oui si l'on considère l'un des stéréoisomères
ou le mélange des deux mais pas en quantité équimolaire, sinon c'est le
racémique qui est inactif sur la lumière polarisée.
3-1-3-3)
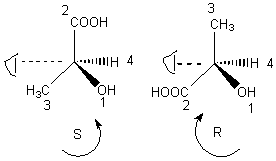
3-2) L'acide tartrique :
3-2-1)
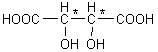
3-2-2) 2n = 22 = 4 (2
carbones asymétriques).
3-2-3) Le stéréoisomère
n'est pas chiral (composé méso) car il possède un plan de symétrie.
4) Un polymère dérivé d'acide : le polyméthacrylate
de méthyle.
4-1) PMMA
4-2) Il est transparent. On l'utilise pour les façades de
balcons.
4-3) Polyaddition.
4-4)
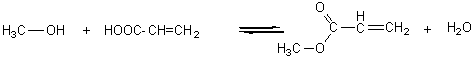
4-5) Estérification.
4-6) Acrylate de méthyle. Fonction
ester.
4-7) Non- Rendement faible pour
une utilisation industrielle.
4-8) On peut mettre du méthanol en
excès ou retirer H2O au fur et à mesure de sa formation.
4-9)
4-9-1) Y ne peut être CONH2 ni CN.
4-9-2) Cx+y+3H2x+2y+4O2
4-9-3) n(12(x+y+3)+2x+2y+4+32) = n(14x + 14y + 72) = M
4-9-4) M = n(14x + 14y + 72). En pourcentage on peut écrire : (32/100).(M/n) =
32 (masse d'oxygène dans une masse M/n de produit) ; soit (M/100n) = 1 et M =
100n. Cela conduit à M = 100n = n(14x + 14y + 72) soit
14(x + y) = 100 -72 = 28 et x + y = 28/14 = 2.
x + y = 2.
4-9-5) La résine ne possédant aucun caractère acide, on ne peut avoir y = 0
donc seule possibilité x = 1 et y = 1.
4-9-6) Résine :