EXERCICE 167
Correction
Enoncé :
Polymérisations
On étudie ici deux polymères issus de
deux types différents de polymérisation.
Données :
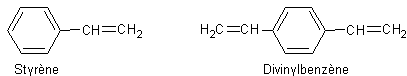
1)
1-1)
Écrire l’équation de la réaction de polymérisation du styrène, puis dessiner le
motif élémentaire du polystyrène ; citer une utilisation courante de ce
polymère.
1-2) Si
on ajoute, avant la polymérisation du styrène, une petite quantité de 1,4-divinylbenzène, on obtient un polymère comportant des ponts
entre les chaînes (réticulation). Caractériser par un adjectif la propriété
physique caractéristique d’un tel polymère.
2)
2-1) Donner
les formules semi-développées de l’acide hexanedioïque
(J) et du 1,6-diaminohexane (K).
2-2) Dessiner le motif élémentaire du polymère P
obtenu par réaction de J avec K ; entourer et nommer la liaison formée.
2-3)
Indiquer le nom commercial de ce polymère très connu.
2-4) La
cohésion du matériau obtenu à partir de P s’explique par l’existence de
liaisons hydrogène entre les chaînes de polymère : faire un schéma représentant
cette liaison entre deux motifs.
3) Préciser le type
de polymérisation mis en jeu lors de la synthèse du polystyrène, ainsi que lors
de la synthèse du polymère P.
Correction :
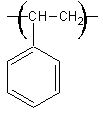
1) 1-1)
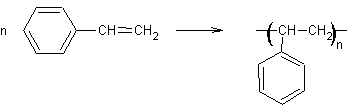
Motif
élémentaire
:
Utilisations
courantes
: pots de yaourt et sous sa forme expansée : glacière et matériau de protection
antichocs.
1-2) Polymère tridimensionnel ou
réticulé.
2) 2-1) Acide hexanedioïque : COOH-CH2-CH2-CH2-CH2-COOH 1,6-diaminohexane NH2-CH2-CH2-CH2-CH2-CH2-CH2-NH2
2-2)
Polymère P obtenu par reaction de J avec K : -(HN-(CH2)6-NH-OC-(CH2)4-CO)n- dont le motif est : - HN-(CH2)6-NH-OC-(CH2)4-CO-
On a souligné la liaison amide formée.
2-3)
Le nom commercial du polymère formé est le nylon.
2-4)
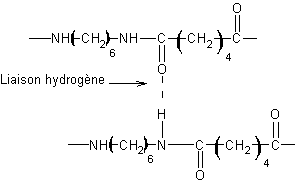
3)
La synthèse du polystyrène est une polymérisation par addition ; celle
du polymère P est une polymérisation par condensation.