Corrigé
Enoncé
 LA CHAPTALISATION
LA CHAPTALISATION
Cet exercice se propose d’étudier le procédé de
chaptalisation décrit par Jean-Antoine Chaptal (1756-1832)
dans son essai L’art
de faire, de gouverner et de perfectionner les vins.
1) Fermentation
alcoolique du glucose
|
En 1801, Jean-Antoine Chaptal écrit : « Le
principe sucré existe dans le moût* et en fait un des principaux caractères,
il disparoît par la fermentation et est remplacé
par l’alcool qui caractérise essentiellement le vin. » Le sucre mentionné est
du glucose contenu dans le jus de raisin, de formule brute C6H12O6
qui, sous l’action des levures de la peau du raisin, se transforme en
éthanol. Cette réaction, dite fermentation alcoolique, produit également du
dioxyde de carbone. * Le moût désigne la mixture obtenue après
pression ou cuisson de fruits ou d'autres produits destinés à la
fermentation. |
1-1) Représenter la formule topologique de
l’éthanol de formule brute C2H6O.
1-2) Quelle est la classe de l’éthanol ?
1-3) Écrire l’équation de la réaction de formation
de l’éthanol lors de la fermentation alcoolique du glucose.
2) Fermentation
alcoolique du saccharose
|
Plus loin, Chaptal précise : « Comme le but et l’effet
de la fermentation spiritueuse se réduisent à produire de l’alcool, en
décomposant le principe sucré, il s’ensuit que la formation de l’un est
toujours en proportion de la destruction de l’autre […] c’est pour cela qu’on
augmente à volonté la quantité d’alcool, en ajoutant du sucre au moût qui paroît en manquer. » Cette méthode d’ajout de sucre a
gardé son nom, la chaptalisation ; elle est utilisée depuis la fin du XVIIIe
siècle. |
Le sucre utilisé pour la chaptalisation est le
saccharose de formule de brute C12H22O11.
L’équation de la réaction de transformation du saccharose en éthanol s’écrit :
C12H22O11 + H2O
®
4 C2H6O + 4 CO2
On appelle degré alcoolique d’un vin d°, le volume
V (exprimé en mL) d'éthanol pur présent dans 100 mL de ce vin. Par exemple, lorsque d° = 7, cela veut dire
que dans 100 mL de vin, il y a 7 mL
d’éthanol pur.
On s’intéresse à la quantité de saccharose à
ajouter pour augmenter le degré alcoolique d’un vin.
Données :
Ø Masse volumique de l’éthanol r
= 0,79 g.mL-1 ;
Ø Masses molaires moléculaires :
M(éthanol) = 46 g.mol-1 ; M ( saccharose)
= 342 g.mol-1 ; M (glucose) = 180 g.mol-1 .
2-1) En considérant la fermentation alcoolique à
partir du saccharose comme une réaction totale, quelle est la relation liant la
quantité de matière de saccharose initiale notée nsaccharose
à la quantité de matière finale d’éthanol obtenue notée néthanol?
2-2) Montrer que la quantité de matière d’éthanol
correspondant à l’augmentation d’un degré alcoolique d’un litre de vin est égale
à 1,7×10-1 mol. En déduire la masse théorique de saccharose
correspondante.
3)
Peut-on chaptaliser le Muscadet ?
Dans l’appellation muscadet, la chaptalisation est
autorisée si la teneur en glucose du moût est inférieure à
161 g.L-1. Pour savoir s’il est possible
légalement d’ajouter du saccharose dans le moût de ce vin, il est nécessaire de
doser le glucose qu’il contient.
Principe du dosage
: On oxyde, à chaud et en milieu basique, le glucose
par l'acide 3,5-dinitrosalycilique (DNS), espèce
chimique incolore. Cette réaction produit l'acide 3-amino-5-nitrosalicylique qui est un composé rouge. Une fois la
réaction avec le DNS terminée, l’acide 3-amino-5-nitrosalicylique formé est dosé par spectrophotométrie
visible. Cette réaction étant totale et le DNS étant en excès, la quantité
d’acide formé est proportionnelle à la quantité de glucose oxydé.
Protocole du
dosage :
Étape 1 : à partir d’une
solution mère de glucose de concentration molaire Cglucose
= 1,0×10-2 mol.L-1 et d’une solution
contenant le DNS, un groupe d’élèves prépare cinq solutions dont ils mesurent
les absorbances, une fois la réaction d’oxydation achevée. Les volumes utilisés
pour préparer ces solutions et les valeurs des absorbances mesurées sont
indiqués dans le tableau ci-dessous.
|
Solution |
1 |
2 |
3 |
4 |
5 |
|
Volume de la solution mère (mL) |
0 |
0,30 |
0,60 |
0,90 |
1,20 |
|
Volume du réactif contenant le DNS (mL) |
2,0 |
2,0 |
2,0 |
2,0 |
2,0 |
|
Volume d’eau distillée (mL) |
3,0 |
2,7 |
2,4 |
2,1 |
1,8 |
|
Absorbance |
0 |
0,25 |
0,51 |
0,74 |
1,1 |
Étape 2 : le groupe
d’élèves prépare une solution X à partir d’une solution de moût du raisin
Muscadet que l’on a dilué 50 fois. Les volumes utilisés pour préparer cette solution
et la valeur de l’absorbance mesurée sont indiqués dans le tableau ci-dessous.
|
Solution |
X |
|
Volume du moût de raisin dilué (mL) |
0,40 |
|
Volume du réactif contenant le DNS (mL) |
2,0 |
|
Volume d’eau distillée (mL) |
2,6 |
|
Absorbance |
0,67 |
Exploitation :
3-1) Pourquoi
a-t-on dilué le moût avant de préparer la solution X ?
3-2) Est-il
possible de rajouter du saccharose dans le moût du raisin de Muscadet dans le
respect de la règlementation ?
On attend pour cette question l’explicitation
détaillée du raisonnement, les calculs et une conclusion.
Corrigé
|
1) |
|
||||||||||||
|
1-1) |
OH |
||||||||||||
|
1-2) |
L’éthanol
est un alcool primaire. |
||||||||||||
|
1-3) |
C6H12O6
à 2CH3CH2OH + 2CO2 |
||||||||||||
|
2) |
|
||||||||||||
|
2-1) |
nsaccharose = néthanol
/4 |
||||||||||||
|
2-2) |
1 degré ó Véthanol = 1 mL d’éthanol dans 100 mL de vin néthanol = et
donc Ainsi msaccharose = néthanol.Msucre
/ 4 =( 1,7.10-1 x 342) / 4 =
15 g |
||||||||||||
|
3) |
|
||||||||||||
|
3-1) |
Pour avoir
une absorbance contenue dans la gamme de résultats de l’étalonnage, on a fait
cette dilution |
||||||||||||
|
3-2) |
Le
corrigé propose une méthode de résolution. Le candidat a la possibilité de
développer une autre méthode de son choix. Calcul de nglucose (ou
de C)
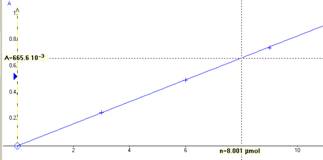
Tracé du
graphe A=f(nglucose)
ou A=f(C) , loi de Beer-Lambert vérifiée ou
régression linéaire sur la calculatrice. Lecture
graphique de la quantité de matière en glucose ou de la concentration C
ou utilisation de l’équation donnée par la calculatrice. dans la
solution X : nglucose = 8,0 μmol soit CX=1,6.10-3 mol/L. Ou
raisonnement par encadrement possible. On en
déduit la concentration de la solution diluée 50 fois : Cglucose = Soit
dans le Muscadet : Cglucose/Muscadet = 50 x CS = 1,0 mol.L-1 Cglucose/Muscadet =
Cglucose/Muscadet x Mglucose = 1,8.102 g.L-1 Ce moût
ne peut pas être chaptalisé car cette valeur est supérieure à 161 g/L. |