EXERCICE 44
Corrigé
Enoncé: Synthèse du 1,1,3-triphénylbutan-1-ol
Pour synthétiser le 1,1,3-triphénylbutan-1-ol, on effectue une suite de réactions à partir de
l'acétophénone (ou phénylméthylcétone):
a)
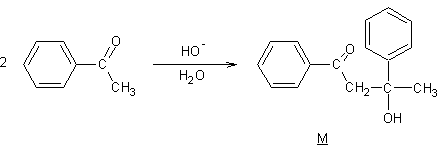
En milieu basique, l'acétophénone subit une réaction de cétolisation
pour former M qui, chauffé
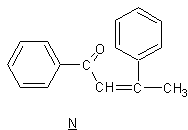
en milieu acide, conduit à N (C16H14O);le spectre
infrarouge de N présente un pic intense vers 1700cm-1;
b) N
réagit ensuite avec le chlorure de phénylmagnésium
pour aboutir, après hydrolyse
en milieu faiblement acide, au produit O; cette transformation suivie
par spectroscopie
infrarouge, s'accompagne de la disparition du pic vers 1700cm-1 et de
l'apparition d'une
bande large et intense vers 3300cm-1 ;
c)
l'hydrogénation catalytique de O conduit au 1,1,3-triphénylbutan-1-ol.
1. L'acétophénone.
1.1 Donner la formule semi-développée de l'acétophénone.
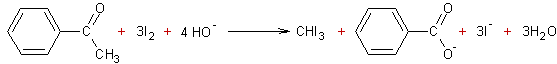
1.2 La réaction du diiode en milieu basique avec
l'acétophénone conduit à l'apparition d'un précipité jaune.
1.2.1 Donner la formule et le nom du précipité obtenu.
1.2.2 Ecrire l'équation de la réaction mise en jeu.
2.
Donner l'équation de la réaction conduisant de l'acétophénone à M.
3.
Donner la formule semi-développée de N.
4.
Obtention de O.
4.1 Donner les équations des deux réactions traduisant le passage de N à
O.
4.2 Interpréter les résultats de l'analyse par spectroscopie infrarouge de
cette transformation.
5.
Stéréochimie.
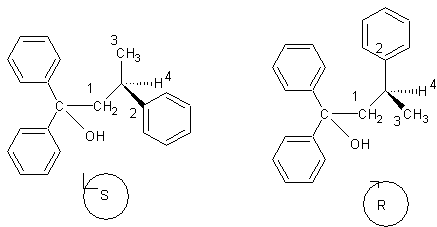
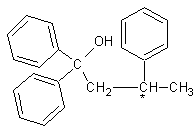
5.1 Dans la formule développée du 1,1,3-triphénylbutan-1-ol, entourer
l'atome de carbone asymétrique.
5.2 Donner la représentation de Cram des deux
énantiomères du 1,1,3-triphénylbutan-1-ol;
les nommer précisément, en explicitant la démarche retenue.
Corrigé :
1) 1-1)
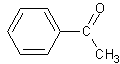
1-2)
1-2-1) CHI3 Tri-iodométhane
1-2-2)
2)
3)
4) 4-1)

4-2)
I.R. la bande à 1700 cm-1 correspond à la liaison C=O ; elle
disparaît puisque cette liaison disparaît ; la bande à 3300 cm-1
apparaît ; elle correspond à la liaison O-H qui apparaît.
5) 5-1)
5-2)