EXERCICE 52
Corrigé
Enoncé :
La codéine comporte les éléments C,H,O,N.
Sa composition centésimale est: 72,4% de carbone, 7% d'hydrogène, 4,7% d'azote.
Sa masse molaire déterminée par spectrographie de masse est 299,4 g.mol-1 .
1) Déterminer sa formule brute.
2) Donner la formule brute de la molécule ci dessous. Coïncide-t-elle avec
celle de la codéine?
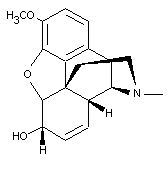
Corrigé :
1)
La composition en oxygène de la codéine est 100 – (72,4 + 7 + 4,7) = 15,9%
Posons
CxHyNzOw
pour formule brute de la codéine ; on peut écrire :
12x/72,4
= y/7 = 14z/4,7 = 16w/15,9 = 299,4/100
Soit
:
x
= 299,4 .72,4/1200 = 18
y
= 299,4.7/100 = 21
z
= 299,4.4,7/1400 = 1
w
= 299,4.15,9/1600 = 3
La
formule brute de la codéine est C18H21NO3.
2)
La formule brute de la molécule présentée est C18H21NO3
; elle coïncide avec celle de la codéine.