EXERCICE
5
Corrigé
Enoncé :
Un composé organique A contient les éléments
Carbone, Hydrogène et Oxygène. L'analyse de 1,932 g de A donne 5,06 g de
dioxyde de carbone et 1,656 g d'eau.
D'autre part, une masse de 5,60 g de A fixe 10,66 g de dibrome, la réaction ayant lieu mole à mole.
Le composé A donne un précipité jaune avec la 2,4-DNPH et un
précipité jaune pâle avec le diiode en milieu
alcalin.
1) Déterminer la masse molaire de A et sa
formule moléculaire.
2) Quels renseignements sur la structure de A
apportent les expériences décrites?
3) En déduire les formules développées des
différents isomères possibles pour A.
4) L'oxydation permanganique de A conduit à
l'acide pyruvique (2-oxopropanoïque) et à l'acide
acétique. En déduire la ou les formule(s) développée(s) possible(s) pour A.
5) Le composé A est traité par le dihydrogène
en excès en présence de nickel de Raney. On obtient
un composé B.
Donner la formule développée de B.
On donne les masses molaires atomiques en g.mol-1
: M(H):
1,0 M(C): 12,0 M(O): 16,0
M(Br):
79,9
Corrigé :
1)
L’addition du dibrome sur A se faisant mole à mole on peut écrire :
![]() qui conduit à écrire
qui conduit à écrire ![]() dans
les proportions stoechiométriques.
dans
les proportions stoechiométriques. ![]() et
et ![]()
![]() . L’égalité des quantités de
matières se traduit alors par
. L’égalité des quantités de
matières se traduit alors par ![]() et l’on en déduit que MA = 84 g.mol-1.
et l’on en déduit que MA = 84 g.mol-1.
5,06 g de CO2 correspondent à
![]() de
carbone pour 1,932 g de A soit une composition centésimale massique de
de
carbone pour 1,932 g de A soit une composition centésimale massique de ![]() .
.
1,656 g d’eau correspondent à ![]() d’hydrogène
pour 1,932 g de A soit une composition centésimale massique de
d’hydrogène
pour 1,932 g de A soit une composition centésimale massique de
![]() .
.
La composition centésimale massique en
oxygène s’en déduit : %O = 100-71,43-9,52 = 19,05%.
Donnons au composé A la formule stoechiométrique CxHyOz .
![]()
Ce qui conduit à x = 5 y = 8 z
= 1
La formule moléculaire de A est C5H8O.
2)
L’addition possible
d’une mole de dibrome sur une mole de A traduit le
fait que A possède une double liaison C=C ; le précipité jaune avec la
2,4-DNPH signifie que A est un composé carbonylé (aldéhyde ou cétone) ; le
précipité jaune pâle avec le diiode en milieu alcalin
indique que A est une cétone méthylée (un groupement
CH3- près du groupement carbonyle).
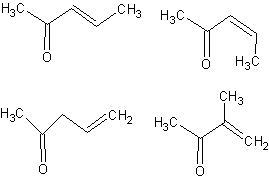
3)
Les formules
semi-développées possibles pour A dans ces conditions sont :
4)
La formule de A peut
être l’une de ces deux formules :
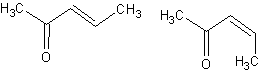
C’est-à-dire :
![]()
5)
La cétone est réduite
en alcool secondaire et la double liaison C=C est hydrogénée (saturée). Le
composé B obtenu a pour formule :
![]()
C’est le pentan-2-ol.