EXERCICE 154
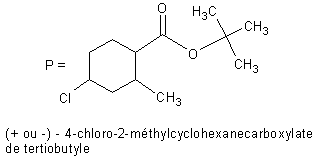
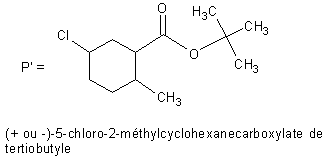
Le trimedlure® est constitué d’un mélange de
deux isomères chlorés : les 4-chloro-2-méthylcyclohexanecarboxylate de tertiobutyle
et 5-chloro-2-méthylcyclohexanecarboxylate
de tertiobutyle.
Il est
connu pour avoir les propriétés d’un biopesticide (paraphéromone) vis-à-vis de la mouche mâle Ceratitis capitata (mouche
méditerranéenne des fruits) qui est le ravageur le plus redoutable en région
méditerranéenne.
Ce
composé attire la mouche dans un piège contenant un insecticide ou même de la
glu. Il permet alors d’évaluer la présence de ces insectes et l’importance de
ces populations avant un traitement éventuel. On évite ainsi l’accumulation
d’insecticides dans les fruits et dans les sols (pollution des nappes
phréatiques).
Une voie
de synthèse possible du trimedlure® en
partant du propyne est décrite ci-dessous.
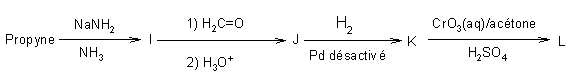
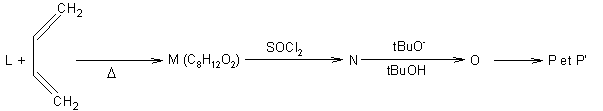
M est un composé
cyclique qui décolore une solution d’eau de brome.
Le trimedlure® correspond au mélange des
isomères P et P’ représentés ci-dessous.
1) Indiquer, les formules semi-développées des molécules I à O.
2) Pour la réaction J → K, donner la formule semi-développée du produit que l’on aurait
obtenu si le platine avait été utilisé comme catalyseur.
3) Indiquer le nom de la réaction L + buta-1,3-diène → M.
4) Pour le passage M → O, on
aurait pu faire réagir directement l’alcool tertiobutylique
(2-méthylpropan-2-ol, noté tBuOH) sur le composé M en milieu acide. Expliquer pourquoi cette méthode est déconseillée.
5) Préciser le nombre maximal de stéréoisomères pour le composé P.
6) L’isomère (1S, 2S, 4R)
du composé P est celui qui
possède l’activité biologique la plus importante. Représenter en projection de Cram cet isomère en complétant la formule suivante (à
recopier sur la copie) :
7) Les données des spectres de RMN 1H
et RMN 13C pour l’isomère (1S, 2S, 4R) du
composé P sont indiquées
ci-dessous.
RMN 1H
|
δ / ppm |
Nombre de protons |
aspect |
|
0,93 |
3 |
doublet |
|
1,30 |
9 |
singulet |
|
1,42 |
1 |
multiplet |
|
1,52 |
2 |
multiplet |
|
1,86 |
2 |
multiplet |
|
1,94 |
2 |
doublet dédoublé |
|
2,80 |
1 |
multiplet |
|
4,66 |
1 |
multiplet |
RMN 13C
|
δ / ppm |
|
18,7 |
|
25,8 |
|
28,2 |
|
33,4 |
|
35,6 |
|
39,6 |
|
41,2 |
|
59,8 |
|
79,7 |
|
172,6 |
7-1) Attribuer les
signaux observés en RMN 1H pour les déplacements chimiques suivants : δ1 = 1,30 ppm ; δ2 = 2,80 ppm ; δ3 = 4,66 ppm. Justifier succinctement.
7-2) Attribuer les
signaux observés en RMN 13C pour les déplacements chimiques suivants : δ1 = 79,7 ppm ; δ2 = 172,6 ppm. Justifier succinctement.
Données :
SPECTROSCOPIE
DE RMN 1H
Domaines de déplacements chimiques des protons des
groupes M (méthyle CH3,méthylène CH2
et méthyne CH) en α ou en β de groupes caractéristiques.
|
Type de proton |
δ en ppm |
Type de proton |
δ en ppm |
|
M-CH2R |
0,8-1,6 |
M-C-CH2R |
0,9-1,6 |
|
M-C=C |
1,6-2,0 |
M-C-C=C |
1,0-1,8 |
|
M-C≡C |
1,7-2,8 |
M-C-C≡C |
1,2-1,8 |
|
M-Ph |
2,2-2,8 |
M-C-Ph |
1,1-1,8 |
|
M-Cl |
3,0-5,0 |
M-C-Cl |
1,5-2,0 |
|
M-Br |
3,4-4,1 |
M-C-Br |
1,8-1,9 |
|
M-I |
3,1-4,2 |
M-C-I |
1,7-2,1 |
|
M-OH et
M-OR |
3,2-3,6 |
M-C-OH et M-C-OR |
1,2-1,8 |
|
M-OPh |
3,8-4,6 |
M-C-OPh |
1,3-2,0 |
|
M-O-CO-R |
3,6-5,0 |
M-C-O-CO-R |
1,3-1,8 |
|
M-O-CO-Ph |
3,8-5,0 |
M-C-O-CO-Ph |
1,6-2,0 |
|
M-CHO et M-CO-R |
2,1-2,6 |
M-C-CHO |
1,1-1,7 |
|
M-CO-Ph |
3,8-5,0 |
M-C-CO-R |
1,1-1,8 |
|
M-CO-OH et
M-CO-OR |
1,8-2, 8 |
M-C-CO-Ph |
1,1-1,9 |
|
M-CO-NR2 |
1,8-2,2 |
M-C-CO-OR |
1,1-1,9 |
|
M-C≡N |
2,2-3,0 |
M-C-CO-NR2 |
1,1-1,8 |
|
M-NH2
et M-NR2 |
2,2-3,0 |
M-C-C≡N |
1,2-2,0 |
|
M-NH-CO-R |
3,0-3,8 |
M-C-NH-CO-R |
1,1-1,9 |
|
M-NO2 |
4,1-4,4 |
M-C-NO2 |
1,6-2,5 |