EXERCICE 148
Réactivité
de l'acétoacétate d'éthyle :
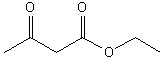
L'acétoacétate d'éthyle ou 3-oxobutanoate
d'éthyle est un b-cétoester que l'on notera A. Il est synthétisé par
condensation de deux molécules d'acétate d'éthyle en présence d'une base forte.
Nous allons dans cette partie nous intéresser à la réactivité particulière de
ce composé :
A
1) Alkylation sélective :
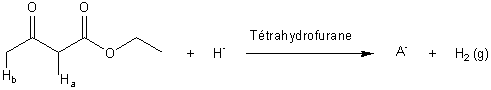
1-1) En solution dans le tétrahydrofurane
anhydre (solvant), le cétoester A est traité
par de l'hydrure de sodium (Na+ + H-) pour
donner un monoanion A- selon
l'équation :
1-1-1) Indiquer pour quelle raison le solvant doit être anhydre ?
1-1-2) Comment peut-on au laboratoire maintenir anhydre le tétrahydrofurane
?
1-1-3) Montrer que les deux atomes d'hydrogène Ha et Hb du cétoester sont
particulièrement acides.
1-1-4) Justifier que le proton Ha soit plus acide que Hb.
En déduire la structure du monoanion A-.
1-2) A la solution de monoanion A- on ajoute goutte à goutte, à
température ambiante, une solution de 1-iodobutane
dans le tétrahydrofurane anhydre. Après réaction puis
neutralisation, on isole un composé B de formule brute C10H18O3.
1-2-1) Donner la structure du composé B obtenu.
1-2-2) Ecrire l'équation bilan de la réaction entre le monoanion
A- et le 1-iodobutane.
1-2-3) Choisir parmi les termes suivants ceux qui s'appliquent à cette réaction
: addition - réduction - élimination - substitution - radicalaire -
électrophile - oxydation - nucléophile.
1-3) Une chromatographie sur couche
mince du 3-oxobutanoate d'éthyle commercial et du
composé B en solution à 1% dans la propanone est réalisée. L'éluant est
un mélange pentane-diéthyléther.
1-3-1) Rappeler le principe d'une chromatographie sur couche mince.
1-3-2) Indiquer les principales étapes de sa réalisation.
1-3-3) Quelle information peut nous révéler le chromatogramme ainsi préparé ?
1-3-4) Comment révéler simplement la plaque ?
1-3-5) Qu'appelle-t-on rapport frontal Rf
? Quel est son intérêt ?
2) Réduction sélective :
2-1) Dans un ballon on mélange 100 mmol de composé A, 110 mmol
d'éthane-1,2-diol, 50 mL de toluène et 0,5g d'acide paratoluènesulfonique
(catalyseur). On adapte le ballon au Dean Stark. Le mélange est chauffé à
reflux jusqu'à ce que le niveau d'eau dans le Dean Stark soit constant. Au
cours de cette réaction, l'eau et le toluène sont les seuls composés volatils.
Ils forment un hétéroazéotrope de température
d'ébullition 84°C et de fraction molaire en eau de 0,45 sous la pression
atmosphérique. A l'état liquide, ils sont non miscibles.
L'équation de la réaction est :

Le composé organique obtenu est le composé C.
Après réaction, la phase organique est neutralisée,
lavée puis séchée sur sulfate de magnésium anhydre. Après évaporation du
solvant, on obtient 15,1 g de composé C solide.
2-1-1) Calculer le rendement de la réaction.
2-1-2) Compléter le schéma en annexe, en indiquant le nom des éléments du
montage et la composition des mélanges liquides.
2-1-3) Indiquer par des flèches le chemin parcouru par les fluides (vapeur ou
liquide) dans le montage. On prendra soin de différencier le toluène et l'eau.
2-1-4) Justifier le terme de recyclage du solvant.
2-1-5) Quel est l'intérêt du Dean et Stark ?
2-1-6) Citer une autre synthèse en chimie organique où ce matériel est utilisé.
2-2) On
réalise ensuite une réduction sélective de la fonction ester de C par
l'hydrure de lithium aluminium LiAlH4 en solution dans le THF anhydre. Après réduction, le mélange est
hydrolysé en présence d'une solution aqueuse d'acide sulfurique. Après
extraction et purification on isole le composé D dont la formule
topologique est :
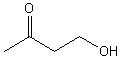
2-2-1) Donner le nom du composé D.
2-2-2) Indiquer l'intérêt d'avoir réalisé l'étape précédente amenant la
formation du composé C pour la synthèse de D.
Annexe :