LE
TRAITEMENT DU DIABÈTE
Le Mediator® et le Mevacor® sont deux médicaments qui
ont été largement prescrits pour lutter contre l’hypercholestérolémie,
notamment chez les patients diabétiques.
Le benfluorex est le principe actif du Mediator®,
médicament commercialisé en France par les laboratoires Servier de 1976 à 2009
pour ses propriétés hypolipidémiantes, hypocholestérolémiantes,
hypoglycémiantes et anorexigènes. Fin 2009, le Mediator® a été retiré du marché
français suite à de nombreux cas de maladies cardiaques décelées chez les
patients traités et fait encore actuellement l’objet de controverses.
La lovastatine, présente à l’état naturel dans un champignon
(le pleurote en huître) et dans la levure de riz rouge, est le principe actif
du Mevacor®, médicament toujours commercialisé dans certains pays comme le
Canada, les Etats-Unis et l’Espagne. La molécule provoque chez les patients
traités un abaissement notable du taux de cholestérol.
Partie
1 :
Synthèse du benfluorex
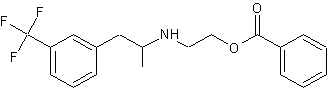
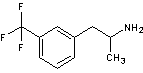
Benfluorex A
Le Mediator® est constitué d’un mélange racémique de
benfluorex A.
1) Préciser ce qu’est un mélange racémique.
2) Représenter les différents stéréoisomères du benfluorex
A. Préciser la (ou les) relation(s) de stéréoisomérie entre les
différents stéréoisomères en expliquant la réponse.
3) Première partie d’une voie de synthèse.
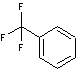
Le trifluorométhylbenzène B
est traité par le chlorure de propanoyle en présence de trichlorure d’aluminium
anhydre pour obtenir un produit C. C est dissous dans l’éthanol
puis soumis à l’action du tétrahydruroborate de sodium. Après hydrolyse, on
obtient un produit D qui présente en spectroscopie Infrarouge les
caractéristiques détaillées dans le tableau en annexe (annexe 6).
Le chauffage de D en
présence d’acide phosphorique concentré (H3PO4) conduit à
un produit E de formule brute C10H9F3
et qui présente la particularité de décolorer l’eau de dibrome. E, mis
en solution dans l’hexane, est traité par du bromure d’hydrogène gazeux, sous
rayonnement UV. On obtient alors un produit F qui, traité par un grand
excès d’ammoniac, conduit à l’amine primaire G.
3-1) Représenter les composés C, D, E
et F dans le tableau de résultats (annexe 5).
3-2) Formation de C
3-2-1) Préciser la nature du mécanisme
réactionnel de la réaction conduisant à la formation de C. Détailler ce mécanisme réactionnel.
3-2-2) Proposer une explication quant à l’orientation
de la réaction.
3-3) Action du
tétrahydruroborate de sodium sur C
3-3-1) Donner l’équation de la réaction de la
molécule C avec le tétrahydruroborate de sodium.
3-3-2) Interpréter le spectre Infrarouge du
composé D en complétant
le tableau en annexe 6.
3.-4) Formation de F
3-4-1) Choisir parmi les termes suivants
celui ou ceux qui décrivent le mieux la réaction de formation de F : addition / élimination /
substitution / électrophile / nucléophile / radicalaire.
3-4-2) Expliquer les conditions
expérimentales choisies pour obtenir le composé F avec la sélectivité voulue.
4)
Fin de la synthèse.
Le benfluorex est finalement
obtenu par réaction de l’amine primaire G sur une molécule H,
dérivée de l’acide benzoïque, selon un mécanisme de type SN2.
Proposer dans le tableau de
résultats (annexe 5) une molécule H susceptible de convenir pour
terminer cette synthèse. Aucune justification n’est demandée.
Partie
2 :
Synthèse de la lovastatine
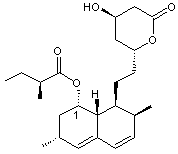
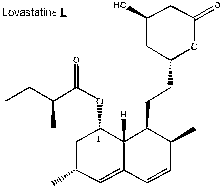
La
lovastatine, notée L dans cette partie est représentée ci-dessus.
1)
Sur l’annexe 7, repérer les atomes de carbone asymétriques sur la molécule de lovastatine L. Préciser combien
la lovastatine L possède de stéréoisomères.
2)
Indiquer la configuration (ou descripteur stéréochimique) de l’atome de carbone
noté 1 en expliquant précisément la démarche suivie.
Dans
cette partie, on se propose d’étudier les dernières étapes, représentées
ci-après, de la synthèse de la lovastatine L, à partir des molécules M
et N. On précise que sur la molécule M, le groupe TBS
(terbutylsilyle) constitue un groupe protecteur des alcools en formant un éther
silylé. La dernière étape de la synthèse correspond à la
« déprotection » (en milieu acide aqueux) de l’éther silylé afin de
retrouver le groupe hydroxyle.
On
précise de plus que le K-sélectride est un agent réducteur qui réagit comme le
tétrahydruroborate de sodium et qui permet d’obtenir sélectivement un
stéréoisomère de configuration cohérente avec la molécule L.