Extrait du texte du concours général des sections STL 2011
Les
additifs et arômes alimentaires
Les
additifs alimentaires sont des produits ajoutés aux aliments dans le but d’en
améliorer la conservation, la couleur, le goût, l’aspect... Quand un additif
alimentaire est autorisé au niveau européen, celui-ci bénéficie d’un code du
type Exyz.
Les arômes,
qui ne sont pas considérés comme des additifs, sont également rencontrés dans
les aliments sous forme d’arômes naturels ou artificiels. Ils sont responsables
du goût et de l’odeur des fruits, des légumes, des viandes, des poissons….
L’industrie agro-alimentaire utilise souvent des arômes industriels pour
reproduire ou renforcer les goûts et les odeurs des aliments.
1) Les colorants alimentaires
Les
colorants alimentaires ajoutent artificiellement de la couleur aux aliments,
pour les rendre en principe plus appétissants.
L’azorubine
(E122) est un colorant rouge utilisé dans les pâtisseries industrielles et dans
le sirop de grenadine. Une de ses synthèses possibles nécessite l’utilisation
de deux molécules (C) et (E) dont le schéma de préparation est rapporté
ci-dessous :
Préparation
de (C) :
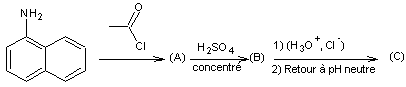
1-1) Identifier les
formules semi-développées des molécules (A), (B) et (C).
1-2) Ecrire
l’équation de la réaction mise en jeu dans le milieu réactionnel lors de la synthèse
de (A).
Afin de
faciliter cette réaction, on ajoute de la pyridine au milieu réactionnel.
Donner deux raisons à cette pratique.
1-3) Indiquer
le nom du réactif H3C—CO—Cl en nomenclature systématique (IUPAC).
1-4)
Justifier l’orientation de la réaction lors de la transformation (A) -> (B).
1-5)
Expliquer l’intérêt de synthétiser (A) afin de former (C).
Préparation
de (E) :
La molécule
(E) est préparée à partir de la molécule (C) :
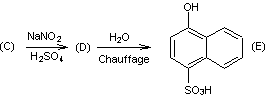
1-6) Indiquer
la formule semi-développée de (D).
1-7) La
molécule (D) est synthétisée à basse température. Que se passerait-il si le
contrôle de température n’était pas respecté ?
Préparation
de l’azorubine
1-8) (C) est
traité par du nitrite de sodium NaNO2 en milieu acide. Après réaction à basse
température, (E) est introduit dans le milieu réactionnel. L’azorubine est
ainsi obtenue. Donner sa formule semi-développée.
1-9) Indiquer
le nom de la réaction qui permet d’obtenir l’azorubine à partir de (C) et (D).
1-10)
Expliquer pourquoi la structure de l’azorubine permet de prévoir qu’il s’agit
d’une espèce colorée.
2) Les conservateurs
Les agents
conservateurs sont des substances dont l'effet direct est de retarder ou empêcher
les modifications microbiologiques indésirables ou nocives dans les denrées
alimentaires, en particulier leur altération.
L’acide
sorbique (E200) est un additif utilisé comme antifongique pour la conservation
des fruits et légumes. On le retrouve donc dans les denrées alimentaires à base
de fruits et légumes (yaourts, cidre,...) mais aussi dans les mayonnaises et
margarines allégées.
Le
but-2-énal réagit avec l’éthanal en milieu basique (NaOH) pour donner (A) dont
la formule semi-développée est donnée ci-dessous :
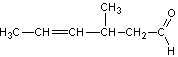
Par
chauffage, (A) se déshydrate pour donner (B). Après oxydation par du dichromate
de potassium en milieu acide, (B) donne l’acide sorbique.
2-1) Donner les formules
semi-développées du but-2-énal et de l’éthanal.
2-2) Indiquer
les formules semi-développées de (B) et de l’acide sorbique.
2-3) Indiquer
le nom de la réaction de formation de (A). Indiquer la formule semi-développée
du carbanion qui se forme intermédiairement dans le milieu réactionnel lors de
cette synthèse.
2-4)
Représenter la molécule d’acide sorbique sachant que la stéréochimie est (E,
E). Justifier la réponse.
3) Les anti-oxydants
Les
antioxydants sont des molécules qui protègent les aliments contre les réactions
d'oxydation qui accélèrent le vieillissement. Il peut s'agir d'altérations dues
à la présence de l'oxygène de l'air, de la lumière, de traces de métaux ou de
certaines enzymes.
L’acide (+)
tartrique (E334) est un antioxydant.
En
nomenclature systématique, son nom est l’acide (2R, 3R)-2,3-dihydroxybutanedioïque.
3-1) Dessiner
l’acide (+) tartrique en représentation de Cram puis en représentation de
Fischer à partir du modèle suivant :
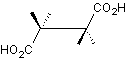
3-2) Donner
la représentation de Cram de tous les stéréoisomères de configuration de
l’acide tartrique. Indiquer, sans justification, la configuration de tous les
atomes de carbone asymétriques. Justifier le nombre de stéréoisomères obtenus.
3-3) Parmi
les isomères représentés en 3-2) indiquer celui qui est nommé l’acide (-)
tartrique. Justifier.
4) Les édulcorants
Un
édulcorant est une substance qui donne une saveur douce aux aliments.
Les deux
édulcorants de synthèse les plus connus sont l’aspartame (E951) et l’acésulfame
de potassium (E950).
4-1)
L’aspartame
La
représentation de Cram de l’aspartame (E951) est la suivante (avec Ph : groupe
phényle de formule C6H5) :
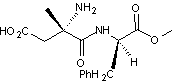
4-1-1)
Préciser le nombre d’atomes de carbone asymétriques dans cette molécule.
Indiquer alors le nombre de stéréoisomères de configuration qu’elle possède.
4-1-2)
Donner la configuration absolue du(des) atome(s) de carbone asymétrique(s).
Justifier la réponse.
4-1-3)
Indiquer les fonctions chimiques présentes dans la molécule, en précisant le
groupe caractéristique qui les définit.
4-2) L’acésulfame
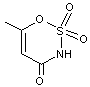
L’acésulfame
(E950) est une espèce très faiblement soluble dans l’eau. Afin de la
solubiliser, elle est mise sous forme ionique.
4-2-1)
La réaction de l’acésulfame avec la potasse (solution aqueuse d’hydroxyde de
potassium) conduit à la base conjuguée de l’acésulfame qui, par
cristallisation, donne l’acésulfame-K, forme commerciale de l’édulcorant.
Donner la formule de l’acésulfame-K sachant que l’atome d’hydrogène arraché est
celui porté par l’atome d’azote.
4-2-2)
Sachant que le pKA de l’acésulfame vaut 2,1, identifier le domaine
de pH de la solution pour lequel l’acésulfame est soluble.
4-2-3)
Expliquer pourquoi l’acésulfame possède un pKA aussi faible en
écrivant trois formes mésomères pour sa base conjuguée.
5) Les arômes
5-1) La
vanilline
La vanille
contient de nombreux composés aromatiques. La note dominante de son parfum est
due à la molécule de vanilline représentée ci-dessous :
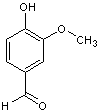
Depuis plus
d’un siècle, la vanilline est surtout produite artificiellement.
Historiquement, la synthèse de la vanilline se faisait en trois étapes à partir
de l’isoeugénol extrait du clou de girofle.
5-1-1)
Par extraction du clou de girofle, on obtient deux composés isomères :
l’eugénol et l’isoeugénol. Indiquer le type d’isomérie existant entre les deux
molécules.
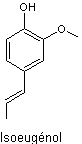
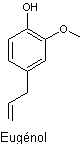
Seul
l’isoeugénol est utilisé pour la synthèse de la vanilline. Afin de limiter les
pertes, l’eugénol est transformé en isoeugénol.
5-1-2)
L’eugénol s’isomérise en milieu basique en isoeugénol. La soude utilisée sert
de catalyseur à la transformation. Expliquer pourquoi l’équilibre chimique
entre l’eugénol et l’isoeugénol est déplacé en faveur de l’isoeugénol.
5-1-3)
Proposer un mécanisme pour cette isomérisation en faisant apparaître un
carbanion intermédiaire dont on écrira deux formes mésomères.
On écrira
l’eugénol sous la forme Ar—CH2—CH=CH2.
L’isoeugénol
est traité par de l’anhydride éthanoïque afin de fournir l’acétate
d’isoeugénol.
L’acétate
d’isoeugénol est transformé en acétate de vanilline.
5-1-4)
Donner les formules semi-développées de l’acétate d’isoeugénol et de l’acétate
de vanilline.
5-1-5)
Proposer des conditions de réaction permettant d’obtenir la vanilline à partir
de l’acétate de vanilline.
5-2) Arôme de noix de coco
La lactone
ci-dessous a le goût et l’odeur de la noix de coco :
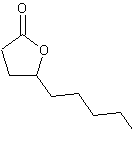
Le malonate
de diéthyle est traité par de l’éthanolate de sodium EtONa afin de former un
carbanion, noté (A).
Malonate de
diéthyle
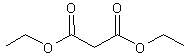
5-2-1)
Proposer une synthèse de l’éthanolate de sodium à partir de l’éthanol.
Justifier la réponse par l’écriture d’une équation de réaction.
5-2-2)
Trois carbanions sont susceptibles de se former dans le milieu réactionnel.
Après avoir écrit la formule des trois carbanions possibles, identifier celui,
(A), qui se forme de façon très majoritaire en justifiant la réponse.
Le
carbanion (A) réagit avec l’heptanal de manière à former un alcool (B)
(réaction similaire à une condensation aldolique croisée) qui se déshydrate en
composé éthylénique (C) dont la formule semi-développée est donnée ci-dessous :
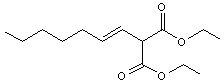
5-2-3)
Donner la formule semi-développée de (B).
Le composé
(C) est hydrolysé en milieu acide puis un chauffage prolongé permet d’obtenir
(D), dont la formule semi-développée est donnée ci-dessous, et un dégagement
gazeux :
![]()
5-2-4)
(D) est traité par de l’eau en milieu acide. On obtient un composé (E) qui, par
cyclisation, fournit la lactone (F) possédant le goût et l’odeur de la noix de
coco.
Donner la
formule semi-developpée et le nom de (E) en nomenclature officielle. Quel est
le nom de la réaction mise en jeu lors du passage de (E) à la lactone (F) ?