EXERCICE 182
Le traitement du diabète
Le Mediator® et le Mevacor®
sont deux médicaments qui ont été largement prescrits pour lutter contre
l’hypercholestérolémie, notamment chez les patients diabétiques.
Le benfluorex est le
principe actif du Mediator®, médicament commercialisé en France par les
laboratoires Servier de 1976 à 2009 pour ses propriétés hypolipidémiantes,
hypocholestérolémiantes, hypoglycémiantes et anorexigènes. Fin 2009, le
Mediator® a été retiré du marché français suite à de nombreux cas de maladies
cardiaques décelées chez les patients traités et fait encore actuellement
l’objet de controverses.
La lovastatine, présente à
l’état naturel dans un champignon (le pleurote en huître) et dans la levure de
riz rouge, est le principe actif du Mevacor®, médicament toujours commercialisé
dans certains pays comme le Canada, les Etats-Unis et l’Espagne. La molécule
provoque chez les patients traités un abaissement notable du taux de
cholestérol.
Chaque partie de ce sujet concerne l’étude d’un principe actif.
Les deux parties de ce sujet sont indépendantes.
- Partie 1 :
Synthèse du benfluorex
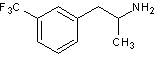
Le Mediator® est constitué
d’un mélange racémique de benfluorex A.
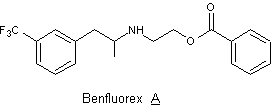
1. Préciser ce qu’est un mélange racémique.
2. Représenter les différents stéréoisomères du benfluorex A.
Préciser la (ou les) relation(s) de stéréoisomérie entre les différents
stéréoisomères en expliquant la réponse.
3. Première partie d’une voie
de synthèse.
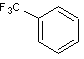
Le trifluorométhylbenzène B est traité par le chlorure de
propanoyle en présence de trichlorure d’aluminium anhydre pour obtenir un
produit C. C est dissous dans l’éthanol puis soumis à l’action du
tétrahydruroborate de sodium. Après hydrolyse, on obtient un produit D
qui présente en spectroscopie Infrarouge les caractéristiques détaillées dans
le tableau en annexe (annexe 6).
Le chauffage de D en présence d’acide phosphorique concentré (H3PO4)
conduit à un produit E de formule brute C10H9F3
et qui présente la particularité de décolorer l’eau de dibrome. E, mis
en solution dans l’hexane, est traité par du bromure d’hydrogène gazeux, sous
rayonnement UV. On obtient alors un produit F qui, traité par un grand
excès d’ammoniac, conduit à l’amine primaire G.
3.1. Représenter les
composés C, D, E et F dans le tableau de résultats
(annexe 5).
3.2. Formation de C
3.2.1.
Préciser la nature du mécanisme réactionnel de la réaction conduisant à la
formation de C. Détailler ce mécanisme réactionnel.
3.2.2.
Proposer une explication quant à l’orientation de la réaction.
3.3. Action du
tétrahydruroborate de sodium sur C
3.3.1.
Donner l’équation de la réaction de la molécule C avec le
tétrahydruroborate de sodium.
3.3.2.
Interpréter le spectre Infrarouge du composé D en complétant le tableau
en annexe 6, (table des nombres
d’onde en fin d'énoncé).
3.4. Formation de F
3.4.1.
Choisir parmi les termes suivants celui ou ceux qui décrivent le mieux la
réaction de formation de F : addition / élimination / substitution
/ électrophile / nucléophile / radicalaire.
3.4.2.
Expliquer les conditions expérimentales choisies pour obtenir le composé F
avec la sélectivité voulue.
4. Fin de la synthèse.
Le benfluorex est finalement obtenu par réaction de l’amine primaire G
sur une molécule H, dérivée de l’acide benzoïque, selon un mécanisme de
type SN2.
Proposer dans le tableau de résultats (annexe 5)
une molécule H susceptible de convenir pour terminer cette synthèse.
Aucune justification n’est demandée.
- Partie 2 :
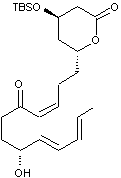
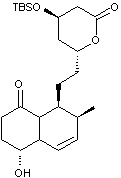
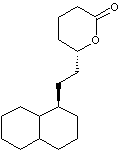
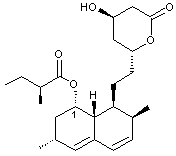
Synthèse de la lovastatine
La lovastatine, notée L dans cette partie est
représentée ci-dessous.
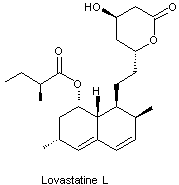
1. Sur l’annexe 7 repérer les atomes de carbone
asymétriques sur la molécule de lovastatine L.
Préciser combien la lovastatine L possède de stéréoisomères.
2. Indiquer la configuration (ou descripteur stéréochimique) de l’atome
de carbone noté 1 en expliquant précisément la démarche suivie.
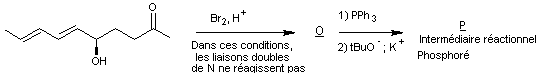
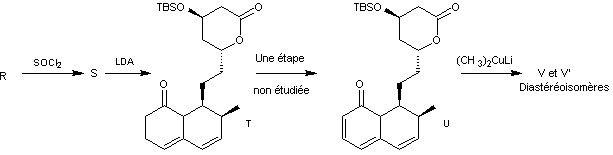
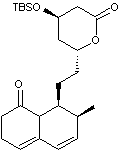
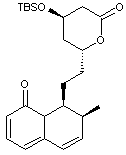
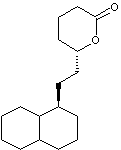
Dans cette partie, on se propose d’étudier les dernières étapes, représentées
ci-après, de la synthèse de la lovastatine L, à partir des molécules M
et N. On précise que sur la molécule M, le groupe TBS
(terbutylsilyle) constitue un groupe protecteur des alcools en formant un éther
silylé. La dernière étape de la synthèse correspond à la
« déprotection » (en milieu acide aqueux) de l’éther silylé afin de
retrouver le groupe hydroxyle.
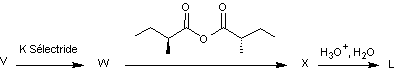
On précise de plus que le K-sélectride est un agent réducteur qui réagit
comme le tétrahydruroborate de sodium et qui permet d’obtenir sélectivement un
stéréoisomère de configuration cohérente avec la molécule L.