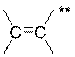EXERCICE 183
Étude
de la vitamine D
La vitamine D est
connue depuis longtemps pour son rôle primordial dans la lutte contre le
rachitisme. En effet, elle joue un rôle déterminant dans la minéralisation des
os, en facilitant l’absorption du calcium et du phosphore.
L’étude de la
vitamine D est décomposée en trois parties indépendantes :
Partie 1 : étude structurale
Partie 2 : analyse spectroscopique de
la 25-hydroxy-vitamine D3
Partie 3 : synthèse de la
25-hydroxy-vitamine D3
Le candidat
trouvera en annexe, une table des nombres d’onde des vibrations d’élongation et
de déformation des liaisons en spectroscopie infrarouge ainsi que les domaines
de déplacement chimique des protons en spectroscopie RMN.
Abréviations
utilisées dans la partie 3
Me groupe méthyle
tBu groupe
tertiobutyle
APTS acide
para-toluènesulfonique
Ac groupe acétyle CH3CO-
DIBALH Hydrure de
diisobutylaluminium Al(CH2-CH(CH3)2)2H
m-CPBA Acide
m-chloroperbenzoïque
MsCl Chlorure de
mésyle CH3SO2Cl
Bn groupe
benzyle Ph-CH2-
Données
m-CPBA Il peut aussi oxyder la
fonction sulfure R-S-R’ en groupe sulfoxyde
RSO2R’
Pyrrolidine pKA = 11,27 de
structure
|
|
Partie 1 : étude structurale
La vitamine D est
désignée comme une vitamine liposoluble. C’est aussi une hormone synthétisée
par l’organisme humain. Elle est à l’origine du calcitriol, hormone qui joue un
rôle essentiel dans la fixation du calcium par l’organisme.
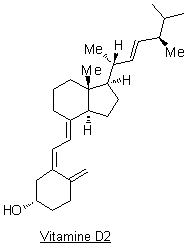
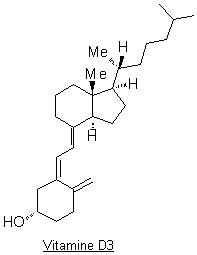
Deux des formes de
la vitamine D ont une activité biologique importante : la vitamine D2
(ergocalciférol) et la vitamine D3 (cholécalciférol).
|
|
|
La vitamine D3
a une origine exogène et endogène :
- elle peut être
apportée, comme toute vitamine, par l’alimentation (origine exogène) ;
- elle peut être
synthétisée par la peau sous l’influence des rayons ultra-violets UVB à
partir du cholestérol (origine endogène).
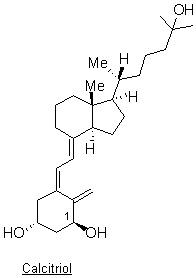
Le calcitriol est
obtenu par transformation biologique de la vitamine D dans le corps humain en
deux étapes. La vitamine D3 est d’abord hydroxylée par le foie en
calcifédiol ou 25-hydroxyvitamine D3 qui est dosable communément
dans le sang. Cette dernière est ensuite hydroxylée par le rein en
calcitriol :
Une quantité
suffisante de vitamine D est nécessaire tout au long de la vie, afin d’éviter
les carences et donc des déséquilibres pouvant entraîner une maladie. Étant
donné qu’il existe peu d’aliments riches en vitamine D, et que l’exposition au
soleil, en France, fait souvent défaut en automne-hiver, une supplémentation
est parfois envisagée.
1.1.
Définir les termes suivants : vitamine ;
liposoluble.
1.2.
Dans la phrase soulignée ci-dessus (Étant
donné…..envisagée), justifier la nécessité d’une exposition au soleil.
1.3.
Existe-t-il une relation d’isomérie quelconque entre
la vitamine D2 et la vitamine D3 ? Justifier en
donnant au moins un argument.
1.4.
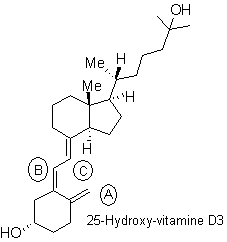
Indiquer la configuration absolue de l’atome de
carbone asymétrique numéroté 1 du calcitriol (voir annexe 2 page 14/18). La
réponse sera clairement explicitée à l’aide des règles de Cahn, Ingold et
Prelog.
1.5.
Indiquer, sur la représentation de la molécule en
annexe 2, la configuration des doubles liaisons C=C du calcitriol.
Partie 2 : analyse
spectroscopique de la 25-hydroxy-vitamine D3
Dans cette partie,
on s’intéresse à la 25-hydroxy-vitamine D3 dont la structure est
donnée ci-dessous :
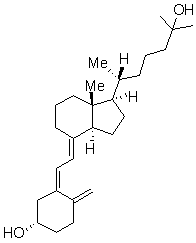
Données sur la
25-hydroxy-vitamine D3 :
|
Formule brute |
C27H44O2 |
|
Masse molaire |
400,64 g.mol-1 |
|
Température de
fusion |
95-106 °C |
|
Spectre UV |
λmax = 265 nm |
|
Spectre
Infra-Rouge (KBr) (données utiles) |
3500, 3360 cm-1 3080, 3030 cm-1 1650, 1635 cm-1 1050 cm-1 900, 880, 860 et
765 cm-1 |
|
Spectre RMN du 1H
(δ, CDCl3, 100 MHz) (données utiles) |
0,54 ppm (3H, s) 0,90 ppm (3H, d, J = 8 Hz) 1,22 ppm (6H, s) 4,80 ppm (1H, s) et 5,00 ppm (1H, s) 5,97 ppm (1H, d, J = 12 Hz) et 6,25 ppm (1H, d, J = 12 Hz) |
2.1. Étude du spectre UV
Proposer une
interprétation à propos de la longueur d’onde maximale observée, sachant que
l’éthène (éthylène) absorbe à 171 nm. Comment appelle-t-on ce phénomène ?
2.2. Étude du spectre IR
2.2.1. Identifier la(les) bande(s) de
vibration(s) d’élongation mettant en évidence la fonction alcool.
2.2.2. Quelles sont les bandes de
vibrations d’élongation mettant en évidence les différentes liaisons C=C
présentes dans la molécule ?
2.3.1. Que représentent δ et 100 MHz dans les données du spectre RMN ?
2.3.2. Préciser le rôle
du chloroforme deutéré CDCl3. Pourquoi le chloroforme
(trichlorométhane) doit-il être deutéré ?
2.3.3. En analysant la structure de la
molécule donnée en annexe 3, identifier les protons responsables des signaux à
0,54 ppm, 0,90 ppm et 1,22 ppm, en les repérant clairement.
2.3.4. Identifier, de manière générale,
quels protons sont responsables des signaux à 4,80 ppm et 5,00 ppm. Justifier
avec précision.
2.3.5. En utilisant la table d’incrément
fournie en annexe 4, page 15/18, calculer le déplacement chimique des protons
éthyléniques HB et HC. Conclure en attribuant les signaux
à 5,97 ppm et 6,25 ppm.
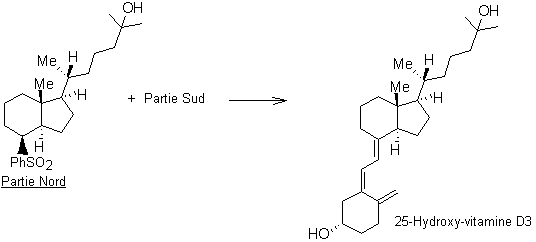
Partie 3 : synthèse de la
25-hydroxy-vitamine D3
La synthèse de la
25-hydroxy-vitamine D3 étant très complexe, les chimistes l’ont
décomposée en deux parties : on appelle « partie Nord » la
partie supérieure de la molécule et « partie Sud » la partie
inférieure.
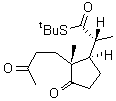
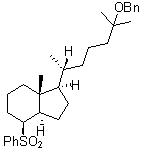
On se limite à la
« partie Nord » dont le schéma de synthèse est fourni
ci-dessous :
HCO2Ac, H+
![]()
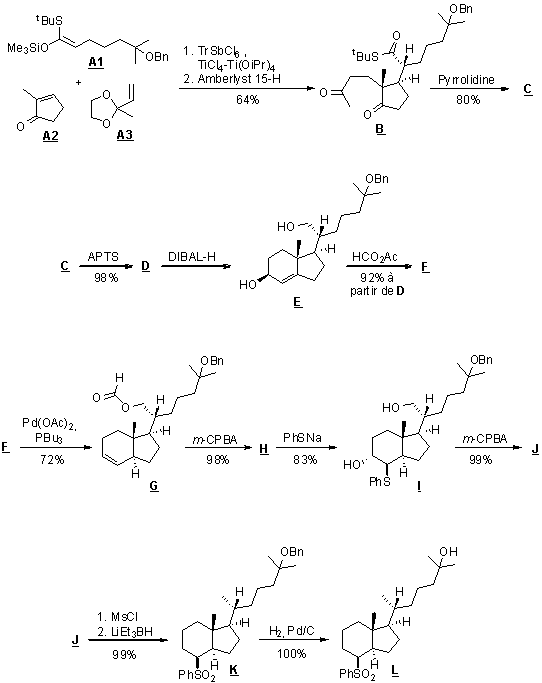
3.1.1. Compléter, au fur et à mesure du traitement des
questions, le tableau de l’annexe 5, en donnant les formules semi-développées
ou topologiques des molécules manquantes (C, D, H et J),
sans tenir compte de la stéréochimie.
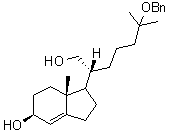
3.1.2. La molécule A3 est obtenue à partir d’une
molécule A4 dont on a protégé une fonction. Donner la formule
semi-développée de A4 et indiquer les réactifs nécessaires pour obtenir A3
à partir de A4.
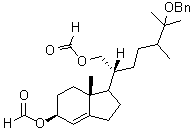
3.1.3. Écrire le mécanisme de la réaction d’aldolisation B
→ C. Préciser le rôle de la pyrrolidine.
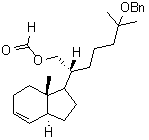
3.1.4. Parmi les termes suivants, lequel caractérise la
transformation D → E : substitution, oxydation,
élimination ou réduction ? Justifier.
3.1.5. Écrire le mécanisme de formation de F à partir
de E sachant que le sous-produit est l’acide éthanoïque. Pour alléger
l’écriture, la molécule E sera notée de façon simplifiée RCH2OH.
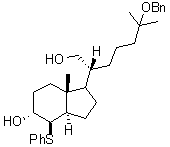
3.1.6. Dans la transformation H → I,
quel est le rôle de l’ion thiophénolate PhS- ? En observant la stéréochimie du produit I,
indiquer de façon précise le type de mécanisme réactionnel mis en jeu lors de
l’ouverture de l’époxyde.
3.1.7. La dernière étape consiste à déprotéger la fonction
alcool. Justifier la nécessité de l’avoir protégée en donnant au minimum un
argument.
3.1.8. Calculer le rendement global de la synthèse.
Annexe 2

Annexe 3
Annexe 4 :
Calcul de
déplacements chimiques de protons éthyléniques
Les protons portés
par un atome de carbone éthylénique subissent un déplacement chimique d’environ
4 à 6 ppm, mais qui peut atteindre 7,5 ppm dans le cas des conjugaisons
intenses qui accroissent le déblindage. Ces déplacements peuvent être prévus
par l’application de la relation empirique suivante :
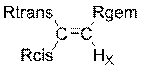
![]()
|
Nature de R |
Z |
||
|
Gem |
Cis |
Trans |
|
|
H |
0 |
0 |
0 |
|
Alkyle |
0,45 |
-0,22 |
-0,28 |
|
|
a.
1,00 b.
1,24 |
-0,09 0,02 |
-0,23 -0,05 |
** b. Valeur à utiliser lorsque le substituant ou la
double liaison est conjugué avec un autre substituant
Annexe 5
Synthèse de la
« partie nord » du 25-Hydroxy-vitamine D3
Feuille de
résultats de la partie 3
|
A |
C |
|
D |
E
|
|
F
|
G
|
|
H |
I
|
|
J |
K
|
Spectroscopie
infrarouge
Table des nombres
d’onde des vibrations d'élongation et de déformation
Ctet :
C tétragonal Ctri :
C trigonal >C= Cdi : C digonal -Cº
|
Liaison |
Nature |
Nombre d’onde
(cm-1) |
Intensité F : fort ; m :
moyen ; f : faible |
|
O-H alcool libre |
Élongation |
3590-3650 |
F (fine) |
|
O-H alcool lié |
Élongation |
3200-3600 |
F (large) |
|
N-H amine |
Élongation |
3300-3500 |
M (deux bandes
si primaire) |
|
N-H amide |
Élongation |
3100-3500 |
F |
|
Cdi-H |
Élongation |
~ 3300 |
M ou f |
|
Ctri-H |
Élongation |
3030-3100 |
M |
|
Ctri-H
aromatique |
Élongation |
3000-3100 |
M |
|
Ctet-H |
Élongation |
2850-2970 |
F |
|
Ctri-H
aldéhyde |
Élongation |
2700-2900 |
M ; 2
bandes |
|
O-H acide
carboxylique |
Élongation |
2500-3200 |
F à m (large) |
|
CºC |
Élongation |
2100-2260 |
F |
|
CºN nitriles |
Élongation |
2200-2260 |
F ou m |
|
C=O anhydride |
Élongation |
1800-1850 1740-1790 |
F |
|
C=O chlorure
d’acide |
Élongation |
1790-1815 |
F |
|
C=O ester |
Élongation |
1735-1750 |
F |
|
C=O aldéhyde et
cétone |
Élongation |
1700-1740 abaissement de ~
20 à 30 cm-1 si conjugaison |
F |
|
C=O acide
carboxylique |
Élongation |
1700-1725 |
F |
|
C=O amide |
Élongation |
1650-1700 |
F |
|
C=C |
Élongation |
1620-1690 |
M |
|
C=C aromatique |
Élongation |
1450-1600 |
Variable ; 3 ou
4 bandes |
|
N=O (de –NO2) Conjugué |
Élongation |
1500-1550 1290-1360 |
F |
|
N=N |
Élongation |
1400-1500 |
f ; parfois
invisible |
|
C=N |
Élongation |
1640-1690 |
F ou m |
|
N-H amine ou amide |
Déformation |
1560-1640 |
F ou m |
|
Ctet-H |
Déformation |
1430-1470 |
F |
|
Ctet-H
(CH3) |
Déformation |
1370-1390 |
F ; 2 bandes |
|
O-H |
Déformation |
1260-1410 |
F |
|
P=O |
Élongation |
1250-1310 |
F |
|
Ctet-O-Ctet
(étheroxydes) |
Élongation |
1070-1150 |
F |
|
Ctet-OH (alcools) |
Élongation |
1010-1200 |
|
|
Ctet-O-Ctri (esters) Ctri-O-Ctri (anhydrides) |
Élongation |
1050-1300 |
F ; 1 ou 2
bandes |
|
C-N |
Élongation |
1020-1220 |
M |
|
C-C |
Élongation |
1000-1250 |
F |
|
C-F |
Élongation |
1000-1040 |
F |
|
Ctri-H de -HC=CH- (E)
(Z) |
Déformation Déformation |
960-970 670-730 |
F M |
|
Ctri-H
aromatique monosubstitué |
Déformation |
730-770 et
680-720 |
F ; 2 bandes |
|
Ctri-H
aromatique o-disubstitué m-disubstitué p-disubstitué |
Déformation Déformation Déformation |
735-770 750-800 et
680-720 800-860 |
F F et m ; 2
bandes F |
|
Ctri-H
aromatique 1,2,3 trisubstitué 1,2,4 trisubstitué 1,3,5 trisubstitué |
Déformation Déformation Déformation |
770-800 et
685-720 860-900 et
800-860 810-865 et
675-730 |
F et m ; 2
bandes F et m ; 2
bandes F et m ; 2
bandes |
|
Ctet-Cl |
Élongation |
600-800 |
F |
|
Ctet-Br |
Élongation |
500-750 |
F |
|
Ctet-I |
Élongation |
» 500 |
F |
Spectroscopie de RMN
du proton
Domaines
de déplacements chimiques des protons des groupes M (méthyle CH3,
méthylène CH2 et méthyne CH) en a ou en b de groupes caractéristiques.
|
type
de proton |
d en ppm |
type
de proton |
d en ppm |
|
CH3-SiR3 M‑CH2R M‑C=C M‑CºC M‑Ph M‑F M‑Cl M‑Br M‑I M‑OH et M‑OR M‑OPh M‑O‑CO‑R M‑O‑CO‑Ph M‑CHO et M‑CO‑R M‑CO‑Ph M‑CO‑OH et M‑CO‑OR M‑CO‑NR2 M‑CºN M‑NH2 et M‑NR2 M‑N+R3 M‑NH‑CO‑R M‑NO2 M‑SH et M‑SR |
0,0-1,0 0,8-1,6 1,6-2,0 1,7-2,8 2,2-2,8 4,2-4,8 3,0-4,0 3,4-4,1 3,1-4,2 3,2-3,6 3,8-4,6 3,6-5,0 3,8-5,0 2,1-2,6 3,8-5,0 1,8-2,6 1,8-2,2 2,2-3,0 2,2-3,0 3,0-3,6 3,0-3,8 4,1-4,4 2,1-5,1 |
M‑C‑CH2R M‑C‑C=C M‑C‑CºC M‑C‑Ph M‑C‑F M‑C‑Cl M‑C‑Br M‑C‑I M‑C‑OH et M‑C‑OR M‑C‑OPh M‑C‑O‑CO‑R M‑C‑O‑CO‑Ph M‑C‑CHO M‑C‑CO‑R M‑C‑CO‑Ph M‑C‑CO‑OR M‑C‑CO‑NR2 M‑C‑CºN M‑C‑N+R3 M‑C‑NH‑CO‑R M‑C‑NO2 M‑C‑SH et M‑C‑SR |
0,9-1,6 1,0-1,8 1,2-1,8 1,1-1,8 1,5-2,2 1,5-2,0 1,8-1,9 1,7-2,1 1,2-1,8 1,3-2,0 1,3-1,8 1,6-2,0 1,1-1,7 1,1-1,8 1,1-1,9 1,1-1,9 1,1-1,8 1,2-2,0 1,4-2,0 1,1-1,9 1,6-2,5 1,3-1,9 |
Domaines de
déplacements chimiques de divers protons
|
type de proton |
d / ppm |
type de proton |
d / ppm |
|
>C(cycle)=CH2 >C=CH2 ‑C=CH‑ ‑C=CH‑ (cyclique) R‑CºC‑H Ar‑H >C=CH‑CO‑ ‑CH=C‑CO‑ R‑CHO Ar‑CHO H‑CO‑O‑ H‑CO‑N< |
4,6 5,3 5,1 5,3 3,1 7,0-9,0 5,9 6,8 9,9 9,9 8,0 8,0 |
‑CO‑OH >C=C‑OH PhH R‑OH Ar‑OH Ar‑OH (avec liaison H intramoléculaire) R‑NH‑ Ar‑NH R‑CO‑NH‑ CHCl3 H2O |
8,5-13 11-17 7,2 0,5-5,5 4,0-7,5 5,5-12,5 0,5-3,0 3,0-5,0 5,0-8,5 7,2 »5,0 |