EXERCICE 185
Synthèse
d’un acide aminé
Ph représente le groupe phényl.
On veut synthétiser la tyrosine, un acide α-aminé essentiel, de formule :
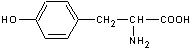
Dans la suite, on pourra utiliser une écriture des molécules faisant apparaître des charges (zwitterion), si besoin est.
1. On traite tout d’abord l’aniline (phénylamine) par du chlorure d’éthanoyle en présence de pyridine, ce qui permet d’obtenir un solide C. Le spectre RMN 1H de C présente un singulet à δ = 2,4 ppm (3H) ; un massif complexe à δ = 7,3 ppm (5H) et un singulet à δ = 8 ppm (1H).
2. C est à nouveau traité par le chlorure d’éthanoyle, mais cette fois-ci, en présence de trichlorure d’aluminium anhydre ; on obtient D majoritairement.
3. D est ensuite hydrolysé en présence d’acide chlorhydrique concentré ; on obtient un composé ionique E’, qui donne E après neutralisation avec un excès de solution de soude.
4. E est soumis à l’action du tétrahydruroborate de sodium pour donner F après hydrolyse. Le spectre IR de F présente deux bandes fines à 3400 et 3450 cm-1 et une bande large et arrondie vers 3300 cm-1.
5. F est ensuite mis en présence d’acide phosphorique concentré à ébullition ; on obtient, après neutralisation, G, dont la formule semi-développée est donnée en annexe 3.
6. G, traité par le bromure d’hydrogène en présence de peroxyde de benzoyle, donne H.
On rappelle la formule du peroxyde de benzoyle :
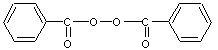
7. H réagit avec le cyanure de potassium (KCN) ; on isole I après purification.
8. I est hydrolysé en milieu acide pour donner J, dont le spectre IR présente entre autres une bande fine et intense à 1700 cm-1 et une bande large et dentelée de 2800 à 3200 cm-1.
9. J réagit ensuite avec le dibrome en présence de phosphore rouge pour donner K de formule brute C9H10NO2Br.
10. K réagit avec le nitrite de sodium dans l’acide chlorhydrique à 5°C : on forme l’espèce intermédiaire L’, qui donne par la suite L et un dégagement gazeux lorsque la solution est progressivement réchauffée à 60°C.
11. L est mis en présence d’un courant gazeux d’ammoniac qui permet de récupérer, après purification, la tyrosine.
Questions
A. Donner les formules semi-développées des composés de C à L, en remplissant le tableau de résultats (annexe 3).
B.
B1. Interpréter complètement le spectre RMN1H de C.
B2. Préciser le rôle de la pyridine lors de la formation de C ; écrire l’équation de réaction correspondante.
C.
C1. Donner le nom et le mécanisme détaillé de la réaction de formation de D.
C2. Justifier l’orientation de la réaction, ainsi que l’obtention de D majoritaire.
D.
D1. Interpréter les données du spectre IR de F.
D2. Écrire l’équation de la réaction de E avec le tétrahydruroborate de sodium.
D3. Donner la formule d’un autre réactif utilisable pour transformer E en F. Préciser les conditions opératoires.
E. Donner le nom et le mécanisme détaillé de l’étape G à H.
F. Indiquer la structure et le nom de la fonction chimique mise en évidence grâce au spectre IR de J.
G.
G1. Écrire l’équation de la réaction conduisant de K à L’. Citer le nom de cette réaction.
G2. Expliquer pourquoi on chauffe le mélange réactionnel pour obtenir L à partir de L’.
H. Indiquer le nombre de stéréoisomères de la tyrosine. Les représenter, en perspective de Cram, en donnant la configuration de chaque atome de carbone asymétrique et préciser la (les) relations (s) qui lie(nt) ces stéréoisomères.
I. Le spectre RMN 13C de la tyrosine fait apparaître notamment un signal situé à δ = 180 ppm. Attribuer ce signal.
Annexe
3
|
C |
D |
|
E' |
E |
|
F |
G
|
|
H |
I |
|
J |
K |
|
L' |
L |
Spectroscopie
infrarouge
Table
des nombres d’onde des vibrations d'élongation et de déformation
Ctet :
C
tétragonal
Ctri : C trigonal
>C=
Cdi : C digonal -Cº
|
Liaison |
Nature |
Nombre
d’onde (cm-1) |
Intensité F :
fort ; m : moyen ; f : faible |
|
O-H
alcool libre |
Élongation |
3590-3650 |
F (fine) |
|
O-H alcool lié |
Élongation |
3200-3600 |
F
(large) |
|
N-H
amine |
Élongation |
3300-3500 |
M
(deux bandes si primaire) |
|
N-H
amide |
Élongation |
3100-3500 |
F |
|
Cdi-H |
Élongation |
~
3300 |
M ou
f |
|
Ctri-H |
Élongation |
3030-3100 |
M |
|
Ctri-H
aromatique |
Élongation |
3000-3100 |
M |
|
Ctet-H |
Élongation |
2850-2970 |
F |
|
Ctri-H
aldéhyde |
Élongation |
2700-2900 |
M ;
2 bandes |
|
O-H
acide carboxylique |
Élongation |
2500-3200 |
F à m
(large) |
|
CºC |
Élongation |
2100-2260 |
F |
|
CºN
nitriles |
Élongation |
2200-2260 |
F ou
m |
|
C=O anhydride |
Élongation |
1800-1850 1740-1790 |
F |
|
C=O
chlorure d’acide |
Élongation |
1790-1815 |
F |
|
C=O
ester |
Élongation |
1735-1750 |
F |
|
C=O
aldéhyde et cétone |
Élongation |
1700-1740 abaissement
de ~ 20 à 30 cm-1 si conjugaison |
F |
|
C=O
acide carboxylique |
Élongation |
1700-1725 |
F |
|
C=O
amide |
Élongation |
1650-1700 |
F |
|
C=C |
Élongation |
1620-1690 |
M |
|
C=C
aromatique |
Élongation |
1450-1600 |
Variable
; 3 ou 4 bandes |
|
N=O (de –NO2) Conjugué |
Élongation |
1500-1550 1290-1360 |
F |
|
N=N |
Élongation |
1400-1500 |
f ;
parfois invisible |
|
C=N |
Élongation |
1640-1690 |
F ou
m |
|
N-H amine ou amide |
Déformation |
1560-1640 |
F ou
m |
|
Ctet-H |
Déformation |
1430-1470 |
F |
|
Ctet-H
(CH3) |
Déformation |
1370-1390 |
F ; 2
bandes |
|
O-H |
Déformation |
1260-1410 |
F |
|
P=O |
Élongation |
1250-1310 |
F |
|
Ctet-O-Ctet
(étheroxydes) |
Élongation |
1070-1150 |
F |
|
Ctet-OH (alcools) |
Élongation |
1010-1200 |
|
|
Ctet-O-Ctri (esters) Ctri-O-Ctri (anhydrides) |
Élongation |
1050-1300 |
F ;
1 ou 2 bandes |
|
C-N |
Élongation |
1020-1220 |
M |
|
C-C |
Élongation |
1000-1250 |
F |
|
C-F |
Élongation |
1000-1040 |
F |
|
Ctri-H de -HC=CH- (E) (Z) |
Déformation Déformation |
960-970 670-730 |
F M |
|
Ctri-H
aromatique monosubstitué |
Déformation |
730-770
et 680-720 |
F ; 2
bandes |
|
Ctri-H
aromatique
o-disubstitué
m-disubstitué
p-disubstitué |
Déformation Déformation Déformation |
735-770 750-800
et 680-720 800-860 |
F F et
m ; 2 bandes F |
|
Ctri-H
aromatique
1,2,3 trisubstitué
1,2,4 trisubstitué
1,3,5 trisubstitué |
Déformation Déformation Déformation |
770-800
et 685-720 860-900
et 800-860 810-865
et 675-730 |
F et
m ; 2 bandes F et
m ; 2 bandes F et
m ; 2 bandes |
|
Ctet-Cl |
Élongation |
600-800 |
F |
|
Ctet-Br |
Élongation |
500-750 |
F |
|
Ctet-I |
Élongation |
» 500 |
F |
Spectroscopie
de RMN du proton
Domaines
de déplacements chimiques des protons des groupes M (méthyle CH3,
méthylène CH2 et méthyne CH) en a ou en b de groupes
caractéristiques.
|
type
de proton |
d en
ppm |
type
de proton |
d en
ppm |
|
CH3-SiR3 |
0,0-1,0 |
M‑C‑CH2R |
0,9-1,6 |
|
M‑CH2R |
0,8-1,6 |
M‑C‑C=C |
1,0-1,8 |
|
M‑C=C |
1,6-2,0 |
M‑C‑CºC |
1,2-1,8 |
|
M‑CºC |
1,7-2,8 |
M‑C‑Ph |
1,1-1,8 |
|
M‑Ph |
2,2-2,8 |
M‑C‑F |
1,5-2,2 |
|
M‑F |
4,2-4,8 |
M‑C‑Cl |
1,5-2,0 |
|
M‑Cl |
3,0-4,0 |
M‑C‑Br |
1,8-1,9 |
|
M‑Br |
3,4-4,1 |
M‑C‑I |
1,7-2,1 |
|
M‑I |
3,1-4,2 |
M‑C‑OH
et M‑C‑OR |
1,2-1,8 |
|
M‑OH et M‑OR |
3,2-3,6 |
M‑C‑OPh |
1,3-2,0 |
|
M‑OPh |
3,8-4,6 |
M‑C‑O‑CO‑R |
1,3-1,8 |
|
M‑O‑CO‑R |
3,6-5,0 |
M‑C‑O‑CO‑Ph |
1,6-2,0 |
|
M‑O‑CO‑Ph |
3,8-5,0 |
M‑C‑CHO |
1,1-1,7 |
|
M‑CHO
et M‑CO‑R |
2,1-2,6 |
M‑C‑CO‑R |
1,1-1,8 |
|
M‑CO‑Ph |
3,8-5,0 |
M‑C‑CO‑Ph |
1,1-1,9 |
|
M‑CO‑OH et M‑CO‑OR |
1,8-2,6 |
M‑C‑CO‑OR |
1,1-1,9 |
|
M‑CO‑NR2 |
1,8-2,2 |
M‑C‑CO‑NR2 |
1,1-1,8 |
|
M‑CºN |
2,2-3,0 |
M‑C‑CºN |
1,2-2,0 |
|
M‑NH2 et M‑NR2 |
2,2-3,0 |
M‑C‑N+R3 |
1,4-2,0 |
|
M‑N+R3 |
3,0-3,6 |
M‑C‑NH‑CO‑R |
1,1-1,9 |
|
M‑NH‑CO‑R |
3,0-3,8 |
M‑C‑NO2 |
1,6-2,5 |
|
M‑NO2 |
4,1-4,4 |
M‑C‑SH et M‑C‑SR |
1,3-1,9 |
|
M‑SH et M‑SR |
2,1-5,1 |
|
|
Domaines
de déplacements chimiques de divers protons
|
type
de proton |
d /
ppm |
type
de proton |
d /
ppm |
|
>C(cycle)=CH2 |
4,6 |
‑CO‑OH |
8,5-13 |
|
>C=CH2 |
5,3 |
>C=C‑OH |
11-17 |
|
‑C=CH‑ |
5,1 |
PhH |
7,2 |
|
‑C=CH‑ (cyclique) |
5,3 |
R‑OH |
0,5-5,5 |
|
R‑CºC‑H |
3,1 |
Ar‑OH |
4,0-7,5 |
|
Ar‑H |
7,0-9,0 |
Ar‑OH (avec liaison H intramoléculaire) |
5,5-12,5 |
|
>C=CH‑CO‑ |
5,9 |
R‑NH‑ |
0,5-3,0 |
|
‑CH=C‑CO‑ |
6,8 |
Ar‑NH |
3,0-5,0 |
|
R‑CHO |
9,9 |
R‑CO‑NH‑ |
5,0-8,5 |
|
Ar‑CHO |
9,9 |
CHCl3 |
7,2 |
|
H‑CO‑O‑ |
8,0 |
H2O |
»5,0 |
|
H‑CO‑N< |
8,0 |
|
|
Spectroscopie de RMN du 13C
|
Type de carbone |
d en ppm |
Type de carbone |
d en ppm |
|
RCH3 |
5-35 |
RCH2NH2 |
20-70 |
|
R2CH2 |
15-50 |
RCH2OH et RCH2OR' |
50-90 |
|
R3CH |
30-60 |
RNO2 |
60-80 |
|
R4C |
25-40 |
RC≡N |
110-130 |
|
R2C=CR2 |
100-150 |
RCONH2 |
150-170 |
|
RC≡CR' |
50-95 |
RCOCl et RCO-O-COR |
150-170 |
|
Aromatique |
110-175 |
RCO2R' |
150-180 |
|
RCH2I |
10-40 |
RCO2H |
160-190 |
|
RCH2Br |
20-40 |
RCHO et RCOR' |
190-220 |
|
RCH2Cl |
25-90 |
|
|