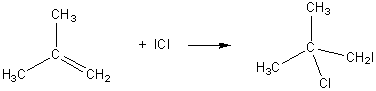QUESTIONNAIRE 67
Correction
ENONCE
1) Addition sur un alcène.
Etablir le mécanisme de l'addition électrophile
de HX sur un composé éthylénique du type :

CORRIGE
1) Tout d'abord H-X se coupe en H+ et X- . La double liaison est un site riche en électron, l'attaque primaire à lieu par H+ pour donner :
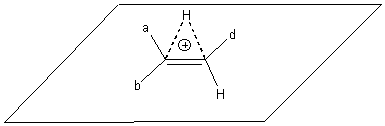
X-
ne peut arriver que par le dessous du plan d'où la dénomination de trans-addition.
H doit alors passer sur le carbone de gauche ou sur
celui de droite et X se fixe sur l'autre carbone.
L'orientation lors de cette addition obéit à la règle
de Markovnikov : l'hydrogène se fixe sur le carbone
le moins substitué. Car le carbocation le plus stable est le carbocation le
plus substitué. Le résultat de cette addition est donc :
ENONCE
2) Halogénoalcane.
a) Par action du sodium sur un mélange de deux dérivés
halogénés du type R-X et R’-X on obtient plusieurs composés. Lesquels ?
b) Quels hydrocarbures halogénés peut-on utiliser pour préparer, par la méthode de Würtz, les deux hydrocarbures saturés suivants :

CORRIGE
2)
1.Par action du sodium sur un halogénoalcane on
obtient un alcane. La présence dans le milieu d'un mélange
d’halogénoalcanes
conduit à un mélange d'alcanes. Le résultat pourra être symétrique du type R-R
ou R’-R’ ; ou mixte du type R-R’.
2.Le 2,3-diméthylbutane est un
alcane symétrique. On peut l'obtenir par réaction de Würtz
sur le 2-bromopropane.
Le 2-méthylbutane est un alcane dissymétrique. Pour l'obtenir
il faut donc partir d'un mélange de deux halogénoalcanes,
l'un sera porteur de la ramification l'autre sera non ramifié.

ENONCE
3) Orientation d'une addition.
L'échelle d'électronégativité de Pauling donne l'élément
chlore Cl comme étant plus électronégatif que l'élément I.
Prévoir la nature du produit de la réaction :

CORRIGE
3) Cl étant plus électronégatif que
I la coupure de I-Cl se fera d'une façon hétérolytique
en donnant Cl- et I+.
Dans un premier temps il se produira l'attaque électrophile par I+ du
doublet d’électrons de la liaison p .
Cl- viendra attaquer le carbocation le plus stable c'est à dire le plus
substitué. L’addition conduira principalement à :