EXERCICE 24
Corrigé
Enoncé
Synthèse
d'un polyester
1) La neutralisation de 0,415g
d'un diacide aromatique BH2
, nécessite 50,0 cm3 d' une
solution d'hydroxyde de sodium, de concentration 0,10 mol.dm3 ; en déduire sa masse molaire.
2) Sachant que ce diacide
renferme 57,83% de carbone, et que les atomes d' oxygène
qu'il possède proviennent de ses fonctions acides, en déduire sa formule brute.
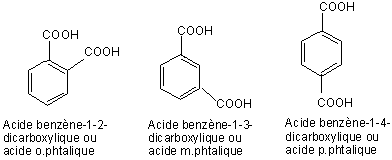
3) Quelles sont les formules
développées possibles pour BH2 ?
4) Ecrire les équations des réactions
qui permettent de préparer l'acide paraphtalique (ou
acide 1,4-benzènedicarboxylique) à partir du benzène
et du monochlorométhane.
5) Ecrire l'équation de
polycondensation de l'acide paraphtalique et de l'éthanediol. Donner au moins une application du polymère
obtenu.
Corrigé
1) Equation de neutralisation :
![]()
Nombre
de moles de BH2dans 0,415g :
![]()
A
l'équivalence :
![]()
En rapprochant (a) et (b) :
![]()
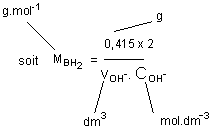
numériquement
:
![]()
2) Soit CxHyOz
sa formule brute
La masse de carbone contenue dans une mole sera :
12x et aussi ![]()
d'où l'égalité 12x = 96 et ![]()
On en déduit y :
y = mH/1 =166 - (96 +4x16) =6 La formule brute est C8H6O4
.
Les
formules développées possibles :
4) Réaction
de Friedel et Crafts :
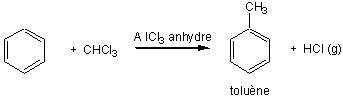
La réaction se poursuit et l'on obtient des dérivés polyalkylés ( polyméthylés
ici).
CH3- orientant la 2ème substitution en ortho et
para avec activation du cycle (règle de Hollemann)
on aura un mélange de
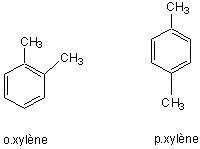
On sépare ces isomères et l'on garde le paraxylène ou
paradiméthylbenzène.
Oxydation du 1,4-diméthylbenzène :
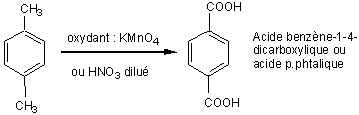
5)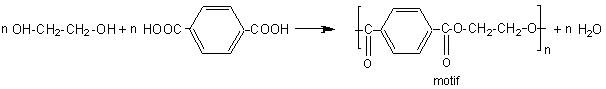
Le produit obtenu PET (polyéthylène téréphtalate) sert
à fabriquer une fibre textile (Tergal - Dacron) ou un film (Mylar ); des bouteilles
(pour eau minérale) en remplacement du PVC.