POLARISATION
D'UNE LIAISON -
EFFET INDUCTEUR- EFFET MESOMERE
Plan de la leçon :
1) Polarisation d'une liaison:
2) Effet
inducteur (ou inductif) :
3) Effet
mésomère :
1) Polarisation et polarisabilité d'une liaison :
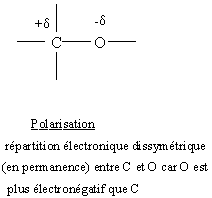
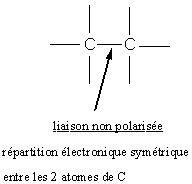

2) Effet inducteur (ou inductif) :
- se traduit par une dissymétrie de la répartition électronique de la liaison covalentesentre 2 atomes, sous l'effet :
- de groupes donneurs d'électrons (effet inducteur répulsif) :
groupes alkyles
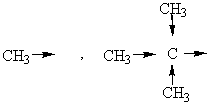
métaux.
- de groupes attracteurs d'électrons (effet inducteur attractif)
F, Cl, Br, I (halogènes: plus électronégatifs que le carbone), OH, NH2, CN, OCH3
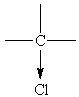
Il favorise parfois l'action de réactifs qui sont riches en électrons (ils attaquent les sites déficitaires d+) ou pauvres en électrons (ils réagiront sur des sites riches en électrons d-).
Exemple : action d'une base sur un dérivé halogéné pour donner un
alcool par substitution:
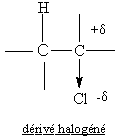
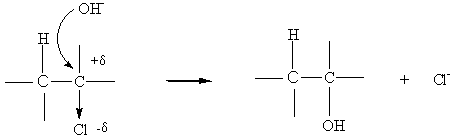
Remarque:l'effet inducteur peut se propager au travers des liaisons
covalentes voisines, mais en
s'affaiblissant :
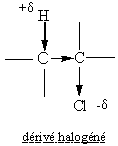
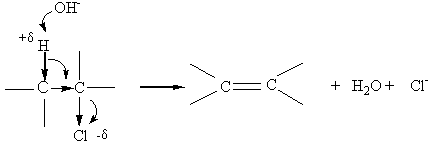
et l'action d'une base sur un dérivé halogéné peut de ce fait aussi conduire à une réaction d'élimination.
3) Effet mésomère : C'est une délocalisation
électronique dans certaines molécules à double ou triple liaison ou à
structure
aromatique :
- 1er exemple : Le benzène
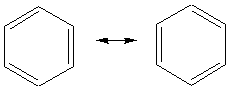
On ne peut représenter convenablement par une seule formule de Lewis, la
structure du noyau benzénique (les
6 électrons sont délocalisés sur les 6 atomes de carbone du cycle). On utilise
donc plusieurs formules qui sont
dîtes mésomères :aucune de ces deux formule ne traduit la structure réelle de
la molécule; celle-ci est un hybride
entre ces formes limites; on dit aussi qu'il y a résonance entre ces formes
limites.
- 2ème exemple : Le chlorure de vinyle
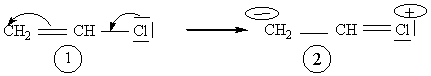
Voici 2 formes limites mésomères de la molécule de chlorure de vinyle; la forme
1 a un poids beaucoup plus
important que la forme 2, ce qui explique que bien que lastructure réelle soit
intermédiaire entre ces deux formes,
elle est plus proche de 1 et c'est cette représentation que l'on adopte pour la
représentation du chlorure de vinyle.
On pourrait représenter ainsi la molécule :
![]()
Il s'agit d'un effet
mésomère donneur du chlore.
- 3ème exemple : Aldéhyde benzoïque
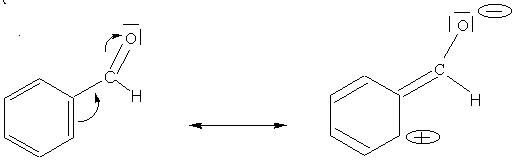
Il s'agit d'un effet mésomère accepteur de l'oxygène.
- 4ème exemple :buta-1,3-diène
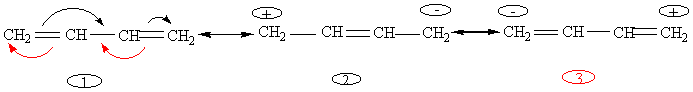
Les formes 2 et 3 ont un "poids" faible comparé à la forme 1. On peut être tenté aussi de représenter la réalité par
![]()
On dit
que les doubles liaisons sont conjuguées.
Remarque : ces formes mésomères expliquent pourquoi l'action de HCl sur le buta-1,3- diène, conduit à 80% de
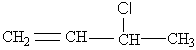
mais aussi 20% de
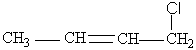
résultat
des formes 2 et 3.
La structure réelle est toujours plus stable que les formes limites qui la représentent.