LES
FOLDAMERES
(Architectures moléculaires repliées
artificielles)
Gérard GOMEZ
Plan de l'étude :
1) Définitions – Foldamères biotiques et
abiotiques
1-1) Définitions
1-2) Foldamères biotiques et abiotiques
2-1) Foldamères à visée thérapeutique
2-2) Foldamères détecteurs moléculaires
2-3) Foldamères moteurs moléculaires
Le domaine des foldamères s'est imposé au fil des années comme une branche à part entière de la
chimie.
1) Définitions – Foldamères biotiques et abiotiques :
1-1) Définitions :
Les foldamères sont des oligomères non naturels, autostructurés.
En 1998 le chimiste Gellman propose, le nom de foldamères, de
l'anglais to fold (plier) ou folding (repliement) à des "polymères
possédant une forte tendance à adopter une conformation spécifique
compacte"
Cette définition a un peu évolué et en 2000, J.S. Moore propose
d'appeler foldamère, "tout oligomère se repliant en un état
conformationnellement stable en solution et dont la structure est stabilisée
par un ensemble d'interactions non covalentes entre des unités monomériques non
adjacentes" ; on voit que cette définition restreint la taille des
polymères en ne désignant ainsi que ceux à taille moyenne (quelques kDa)
c'est-à-dire les oligomères et précise les interactions qui participent à leur
repliement.
Car ces entités ont une aptitude au repliement, ce qu'on a pensé
pendant longtemps et jusqu'à récemment être l'apanage des biopolymères.
1-2) Foldamères biotiques et abiotiques :
On peut séparer les foldamères en deux catégories, les biotiques
et les abiotiques.
- Foldamères biotiques
Ces oligomères tentent de reproduire ce qui se passe naturellement
pour les protéines ou les acides nucléiques (ARN, ADN) et on les qualifie de
peptidomimétiques lorsqu'elles miment les peptides et de nucléomimétiques
lorsqu'elles miment les acides nucléiques.
La structure des protéines provient :
- pour la
structure primaire de l'encombrement des différents acides aminés qui la
composent et des angles qu'ils imposent à l'ensemble.
- pour les structures
secondaire, tertiaire et quaternaire des interactions non covalentes de faible
énergie (liaisons hydrogène, interactions électrostatiques et de Van Der Walls,
interactions p-p (ou p-p stacking)) ou de liaisons covalentes (ponts disulfure) qui permettent
une structuration dans l'espace tout en gardant de la flexibilité (par rupture
possible des liaisons de faible énergie).
Munies de ces structures tridimensionnelles souvent complexes ces
macromolécules naturelles peuvent réaliser des opérations chimiques importantes
comme la catalyse, la reconnaissance moléculaire, le stockage et la duplication
de l'information, la conversion le transport et le stockage d'énergie.
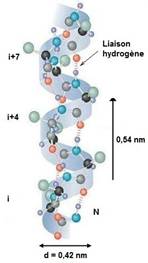
La structure secondaire en hélice α d'un peptide :
|
|
Il s'agit d'une hélice droite contenant 3,6 résidus d'acide
aminé par tour ; la translation par tour lorsqu'on progresse le long de
l'hélice est 0,54 nm ; le diamètre est 0,42 nm. On la désigne par hélice 3,613 , 13 étant le nombre
d'atomes du cycle délimité par la liaison hydrogène. |
Cette structure est celle qui prédomine dans les foldamères ; les
feuillets β, autre grande famille de structure secondaire présente dans
les protéines et qui représente 30% des structures naturelles, sont difficiles
à reproduire dans les foldamères car ils impliquent des liaisons hydrogène
entre des résidus très éloignés.
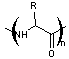
Les foldamères biotiques sont construits comme les peptides
naturels à partir d'acides aminés, mais alors qu'il s'agit exclusivement
d'acides a-aminés
pour les peptides naturels, on utilise des acides β ou γ ou d aminés
non naturels pour les foldamères ; il s'agit dans tous les cas de composés
aliphatiques.
On y trouve un enchaînement de fonctions amide,
|
|
|
|
|
|
Peptide α |
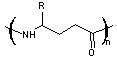
Peptide β |
Peptide γ |
Peptide d |
le repliement étant l'œuvre des interactions électrostatiques et
de Van Der Walls ainsi que des liaisons hydrogène.
Exemple de β-peptide :
|
|
Il s'agit d'un β-peptide ; le Poly-β-hAla ; c'est une
hélice 12. |
L'enchaînement des acides aminés peut d'ailleurs être mixte par
exemple α/β
|
|
|
Peptide α/β |
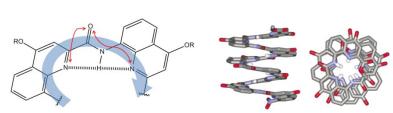
Gellman a par exemple travaillé sur des peptides naturels dans
lesquels il a remplacé des acides aminés α par leurs homologues β.
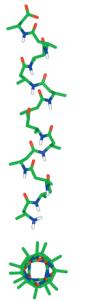
Comme les peptides naturels ces foldamères se replient en hélice
avec un cœur hydrophobe.
C'est ce qui apparaît ci-dessous dans la structure
cristallographique du faisceau d'hélice conçu par Gellman (les peptides β
sont représentés en cyan) :
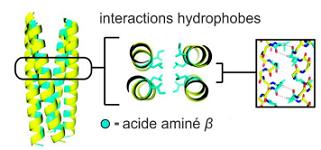
Cette illustration est extraite de la thèse de :
Maëlle Vallade. Reconnaissance de surfaces de protéines par les
foldamères d’oligoamides aromatiques. Chimie organique. Université de Bordeaux,
2016.
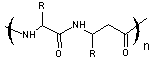
- Foldamères
abiotiques
Les foldamères abiotiques sont construits à partir de
"briques" différentes de celles utilisées pour les foldamères
biotiques ; elles sont aliphatiques ou aromatiques ; les liens sont divers :
amides, urées, imides ou hydrazides.
- Citons entre autres les oligourées dont
il est donné un exemple ci-dessous :
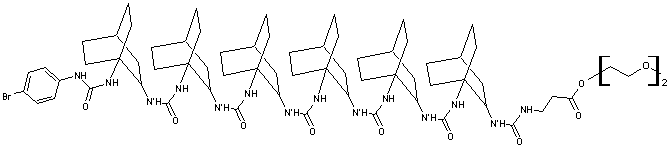
- Les oligoamides aliphatiques ou
aromatiques synthétisés à partir d'acides aminés non naturels
(β,γ ou d)
Ø
En voici un exemple :
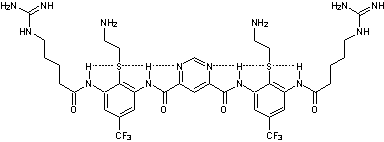
Il s'agit d'un mime synthétique de peptides antimicrobiens ; les
liaisons hydrogène permettant le repliement sont figurées en pointillés.
Ø
En voici un deuxième
exemple :
Cette illustration est extraite de la thèse de :
Jeremie Buratto. Reconnaissance de surfaces protéiques par des
foldamères d’oligoamides aromatiques. Cristallographie. Université de Bordeaux,
2014
Il s'agit d'une oligoquinoléine qui mène à une hélice de diamètre
1 nm, de pas 0,34 nm et 2,5 unités par tour. Cette conformation se montrant
très stable dans l'eau.
2-1)
Foldamères à visée thérapeutique :
- Directe
:
·
La thèse de doctorat de
Madame Marie Jouanne intitulée "Conception et synthèse de
foldamères à visée thérapeutique" soutenue en 2015 à Caen (dans le cadre
de l'Ecole doctorale Normande de biologie intégrative, santé et environnement
(Mont-Saint-Aignan, Seine maritime)) dont le résumé est reproduit
ci-dessous, donne un exemple des possibilités que ces foldamères peuvent
apporter dans le domaine thérapeutique :
" La maladie d’Alzheimer se caractérise par une évolution lente au cours
de laquelle des agrégats de différentes protéines se forment et provoquent une
toxicité cellulaire puis une neurodégénérescence. Le peptide β-amyloïde et
la protéine tau figurent parmi les principales protéines agrégantes et sont
respectivement impliqués dans la formation des plaques et des fibres. Une
stratégie pour lutter contre l’évolution de la maladie consiste à réduire la
formation de ces agrégats, en particulier dans les phases initiales (inhibition
de l’oligomérisation, de la dimérisation). Au vu de l’expérience du laboratoire
dans le domaine des foldamères, nous avons pensé concevoir et préparer des
composés dont la conformation et l’aménagement fonctionnel pourraient permettre
d’interagir avec la ou les séquences de la protéine tau impliquées dans son
agrégation. Les travaux réalisés au cours de cette thèse ont permis dans une
nouvelle approche de concevoir et synthétiser plus de quarante nouvelles
structures dans le but de perturber le processus d’agrégation de la protéine
tau dans le cadre de la recherche de thérapeutiques nouvelles de la maladie
d’Alzheimer."
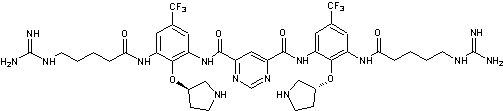
·
La brilacidine est un
foldamère arylamide peptidomimétique des défensines humaines ; elle a une haute
activité contre les bactéries Gram(+) et Gram(-) :
- Indirecte
:
Une encapsulation de l'acide tartrique a pu être réalisée
par des foldamères ; ils enveloppent complètement la molécule et l'isolent du
solvant.
L'hélice (de diamètre variable) qui encapsule cette molécule
tourne mais son sens de rotation dépend de l'énantiomère concerné ; c'est une
différentiation importante quand on sait que pour des médicaments, deux
énantiomères n'ont pas, souvent, le même effet sur l'organisme.
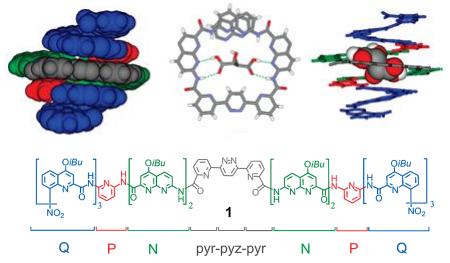
Un exemple de foldamère hélicoïdal permettant l'encapsulation de
l'acide L-tartrique :
|
|
En haut à gauche : Représentation en sphères de la structure de l’acide tartrique L
dans la cavité d’une hélice gauche (les chaînes isobutoxy (iBu) et les molécules
d’eau ne sont pas représentées). En haut à droite : Même représentation en bâtonnets En haut, au milieu : Vue de haut du même complexe avec les liaisons hydrogène
représentées en pointillés verts. En bas : La séquence du foldamère utilisant différents monomères
quinoléines (Q), pyridines (P) et 1,8-naphthyridines (N) permettant de créer
la cavité, avec l’élément central composé des unités
pyridine-pyridazine-pyridine. |
Cette illustration est extraite de la thèse de :
Jeremie Buratto. Reconnaissance de surfaces protéiques par des
foldamères d’oligoamides aromatiques. Cristallographie. Université de Bordeaux,
2014
2-2)
Foldamères détecteurs moléculaires :
Leur structure modulable aussi bien en surface qu'au niveau des
cavités qu'ils délimitent, leur permet d'avoir des applications dans le domaine
de la reconnaissance moléculaire.
La thèse de doctorat de Monsieur Antoine Jacquet : " Capsules
hélicoïdales d’oligoamides aromatiques : détecteurs moléculaires pour le
dosage d’acides organiques du vin" Soutenue en 2017
à Bordeaux (dans le cadre de École
doctorale des sciences chimiques (Talence, Gironde)) dont le
résumé est reproduit ci-dessous nous montre un autre type d'application :
"Les foldamères – structures oligomériques artificielles
adoptant une forme repliée définie – permettent la conception de récepteurs
moléculaires de type capsule capables de reconnaitre sélectivement certains
analytes pertinents du vin. En particulier, des récepteurs sélectifs et affins
du fructose, de l’acide tartrique et de l’acide malique ont été identifiés au
cours de ces dernières années. Le développement d’une méthodologie de synthèse
sur support solide d’un récepteur moléculaire de l’acide gluconique sera abordé
dans ce manuscrit. Cette thèse montre également comment certains de ces
récepteurs peuvent être convertis en détecteurs capables d’émettre un signal en
présence de l’analyte. La démarche est centrée sur l’incorporation d’un
fluorophore au sein du site de reconnaissance. Une preuve de concept a ainsi
été effectuée avec le dosage par fluorescence de l’acide tartrique. Enfin, le
greffage de ce détecteur moléculaire à la surface de particules de silice a été
réalisé et ouvre la voie au développement de dispositifs portables pour le
dosage des analytes reconnus. De tels détecteurs sont requis par l’industrie du
vin afin d’assurer le contrôle des processus biologiques, en particulier durant
la fermentation."
2-3) Foldamères moteurs moléculaires :
- Un premier
moteur moléculaire auto-assemblé a été produit en 2011 à Bordeaux (CNRS) ; il
s'agit d'une tige moléculaire autour de laquelle une hélice foldamère s'enroule
spontanément et vient coulisser en reproduisant le mouvement d'un piston :
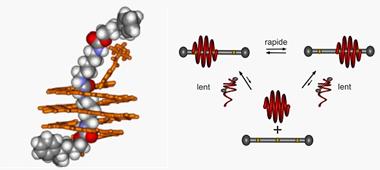
"C'est l'acidité du milieu dans lequel baigne le moteur
moléculaire qui contrôle l'avancée de l'hélice sur l'axe : en augmentant
l'acidité on pousse l'hélice vers une extrémité de l'axe, car elle possède alors
une affinité pour cette portion de la molécule filiforme ; en réduisant
l'acidité, on inverse le processus et l'hélice fait machine arrière."
(Extrait de l'article de presse du 4 mars 2011 du CNRS intitulé
"Une percée dans la conception de moteurs moléculaires").
Ce dispositif pourrait par exemple permettre de fabriquer des muscles
artificiels.