ELECTROSYNTHESE – APPLICATIONS EN CHIMIE
ORGANIQUE
Cet
article a été inspiré par le sujet de chimie de l'Agrégation externe 2020 ; il
en contient des extraits.
Gérard
GOMEZ
Plan de l'étude
1) Définition
2) Des exemples
d'électrosynthèses
2-1)
Electrolyse de Kolbe
2-2)
Oxydation de Shono
2-3)
Electrosynthèse de l’éthylène glycol
2-4)
Hydrodimérisation de l'acrylonitrile en adiponitrile
2-5)
Electrosynthèse de l'acide dihydrophtalique
2-6)
Electrosynthèse de l'acide monochloracétique à partir de
l'acide dichloracétique
2-7)
Electrosynthèse du Fénoprofène
3) Avantage des
procédés électrochimiques en synthèse organique
4) Synthèse totale
de l'alliacol par Moeller
Annexe 1 Bromure de tétra (n-butyle)
ammonium
Annexe 2 Umpolung
1) Définition :
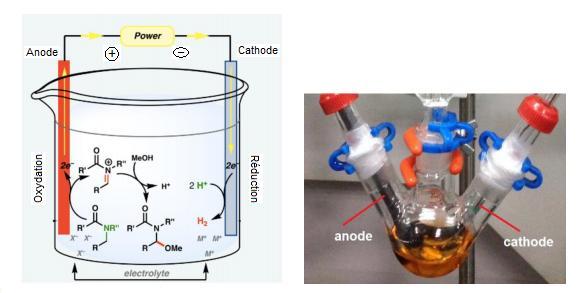
L’électrosynthèse
est une méthode de synthèse utilisant un procédé électrolytique, l’électrolyse,
qui permet la réalisation d’une transformation non spontanée en générant un
courant électrique dans une cellule par application d’une tension aux bornes de
deux électrodes. Plusieurs procédés industriels courants de synthèse minérale
sont des procédés électrolytiques (productions d’aluminium, de dichlore,
d’hypochlorite de sodium, etc) mais des électrolyses sont aussi mises en œuvre
en synthèse organique.
L’électrosynthèse
organique repose sur la réactivité des substrats organiques vis-à-vis des
électrons échangés avec une électrode (anode ou cathode) ; on observe alors une
oxydation ou une réduction du substrat. Ces réactions d’électrosynthèse
organique se déroulent dans des réacteurs électrochimiques avec ou sans
séparation des deux compartiments.
Les
synthèses électrochimiques qui ont des points communs avec les conversions
photochimiques, sont des méthodes intéressantes pour l'élaboration de composés
organiques ; elles mettent en jeu des réductions, des oxydations, des couplages
C-C ….
2) Des exemples d'électrosynthèses :
2-1) Electrolyse
de Kolbe
D'un
point de vue historique cette réaction est intéressante car elle fut l'une des
premières électrosynthèses.
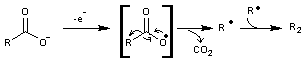
En 1849
Kolbe met au point une oxydation électrochimique par perte d'un électron d'une
fonction carboxylate ce qui conduit à un radical et à une décarboxylation ; par
dimérisation du radical on obtient un alcane.
- A l'anode le
mécanisme est le suivant :
-
A la cathode
![]()
![]()
L'équation
bilan peut s'écrire :
![]()
2-2) Oxydation
de Shono
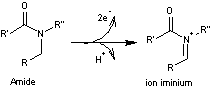
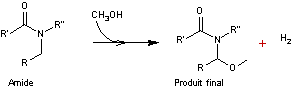
C'est
une électrosynthèse permettant d’obtenir un ion iminium à partir d’une amine ou
d'un amide, en cellule électrochimique non divisée. Ce procédé, développé à
partir de 1975, a été l’un des plus étudiés et utilisés jusqu’à nos jours.
|
La
synthèse présentée ici est réalisée à partir d'un amide qui subit une oxydation
anodique.
- A l'anode
l'ion
iminium formé réagit avec du méthanol
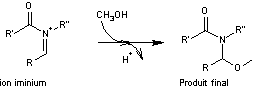
- A la cathode
![]()
![]()
Au
total
2-3) Electrosynthèse
de l’éthylène glycol
L'éthylène
glycol ou éthane-1,2-diol est un antigel très efficace car
il a un point de fusion assez bas et un point d'ébullition élevé.
On peut
le synthétiser en électrolysant une solution de méthanal (formaldéhyde) avec
électrodes de graphite.
·
Electrolyte : solution aqueuse de
formaldéhyde (méthanal) à 37% avec 1% de potasse ajoutée
·
Electrodes de graphite
·
Produit : éthylèneglycol
Le
méthanal subit une réduction cathodique et devient un radical anion ; deux de
ces entités s'unissent ensuite pour donner le dianion de l'éthylène glycol.
- A la cathode
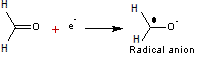
puis
![]()
et
![]()
- A l'anode
![]()
![]()
Au
total
![]()
2-4) Hydrodimérisation
de l'acrylonitrile en adiponitrile
L'adiponitrile
(ou nitrile correspondant à l'acide adipique)
![]()
est un
intermédiaire clé dans la fabrication du nylon 6-6.
Cette
synthèse est l'une des applications industrielles les plus importantes de
l'électrosynthèse organique.
- A la cathode
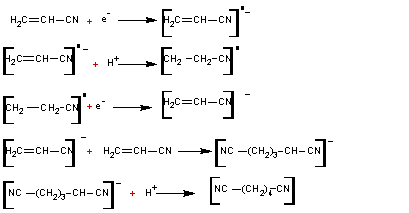
- A l'anode
![]()
![]()
Au
total
![]()
Plusieurs
procédés de fabrication industrielle :
- Procédé Monsanto : en solution
concentrée, 170 000 tonnes par an.
- Procédé Asahi : en émulsion, 30
000 tonnes par an.
Les
procédés actuels d'hydrodimérisation de l'acrylonitrile utilisent une cellule
d'électrolyse comportant un seul compartiment, une cathode en cadmium ou en
plomb électrodéposé sur de l'acier, une anode d'acier inoxydable et un
électrolyte contenant initialement :
- un tampon phosphate
neutre et un sel d'ammonium quaternaire en solution aqueuse,
- le réactif,
l'acrylonitrile,
- et ultérieurement,
l'adiponitrile formé.
La
température de la cellule pendant l'électrolyse est de 50°C.
2-5) Electrosynthèse
de l'acide dihydrophtalique
L'acide
dihydrophtalique est un intermédiaire dans la synthèse des plastifiants ; c'est
aussi un additif pour l'essence qui a été produit par BASF.
On
l'obtient par réduction cathodique de l'acide phtalique en présence d'eau et
d'acide sulfurique, le dioxanne jouant le rôle de solvant.
- A la cathode
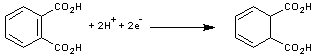
- A l'anode
![]()
![]()
Au
total
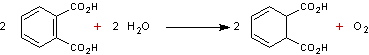
2-6) Electrosynthèse
de l'acide monochloracétique à partir de l'acide dichloracétique
En
chlorant l'acide acétique on obtient un produit principal qui est l'acide
monochloracétique ; il se forme en même temps les acides dichloracétique et
trichloracétique qui constituent donc des sous-produits de cette synthèse.
On peut
les récupérer en les séparant du milieu puis les électrolyser pour les
transformer en acide monochloracétique ce qui permet d'augmenter le rendement
de la synthèse. C'est un procédé qui a été mis au point par la firme Hoechst
AG.
L'acide monochloracétique
ou AMCA est un intermédiaire chimique entrant dans la fabrication de
détergents, d'adhésifs, de produits auxiliaires textiles et d'épaississants
utilisés dans les produits alimentaires, les produits pharmaceutiques et les
cosmétiques.
Il est utilisé en
association à l’aniline pour synthétiser l’indigo à l’échelle industrielle (procédé de Karl
Heumann).
Nous
prendrons l'exemple de l'acide dichloracétique qui conduit à l'acide
monochloroacétique par réduction cathodique.
L'électrolyse
a lieu en présence d'acide chlorhydrique, les électrodes étant en graphite.
- A la cathode
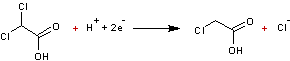
- A l'anode
![]()
![]()
Au
total
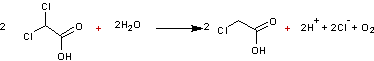
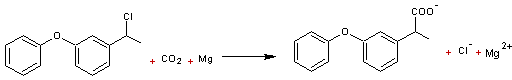
2-7)
Electrosynthèse du Fénoprofène
Le Fénoprofène est un
anti-inflammatoire non stéroïdien (AINS) ayant une activité antalgique et
antipyrétique à faibles doses ; il est utilisé pour soulager l'arthrose et la
polyarthrite rhumatoïde.
Il est obtenu par réduction
cathodique puis carboxylation par CO2 gazeux du chloroéthyldiphényl
éther.
L'électrolyse a lieu avec une anode
en magnésium, une cathode en acier ; le milieu est rendu conducteur par
addition de1% de bromure de n-tétrabutyle ammonium en solution dans le diméthylformamide
(DMF) (voir annexe 1)
- A la cathode

- A l'anode
![]()
L'anode
en magnésium (dite anode sacrificielle) permet d'éviter toute réaction
parasite.
![]()
Au
total
3) Avantage des procédés électrochimiques en synthèse organique
L’utilisation
de procédés électrochimiques en synthèse organique présente de nombreux
avantages :
· Les électrons sont des « réactifs »
peu chers, et plus faciles à transporter que les oxydants ou réducteurs usuels.
· Ces réactions ne génèrent ni déchets
toxiques, ni danger d’explosion, ni difficultés de stockage ou de fabrication
de réactifs dangereux contrairement parfois à l’utilisation d’oxydants ou
réducteurs « chimiques », et se déroulent en général à température ambiante.
· Le nombre total d’étapes est souvent
réduit, notamment car il y a moins de sous-produits que lors de l’utilisation
d’oxydants ou réducteurs classiques, ce qui réduit les phases de traitement.
· La sélectivité des réactions aux
électrodes est en général bonne, et ces réactions permettent un accès direct —
notamment par « Umpolung » — (voir annexe 2) à des
produits difficiles à obtenir par des voies plus classiques.
· La synthèse électrochimique est
aisément transposable à l’échelle industrielle.
4) Synthèse totale de l'alliacol par Moeller
Le
(+)-alliacol est un sesquiterpène isolé en 1977 d'un champignon Marasmius
Allianceus.
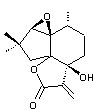
Ce
composé présente une activité antimicrobienne modérée ainsi qu'une activité
antitumorale à faible concentration.
Sa
structure polycyclique et sa stéréochimie en font une cible intéressante en
synthèse totale.
Celle
réalisée par Kevin D Moeller en 2003 utilise une étape clé de cyclisation
électrochimique.

Le composé
(-1- ) est cyclisé par électrolyse pour conduire à l’intermédiaire (A) non
isolé, qui est ensuite transformé en (-2-) par action de l’acide
p-toluènesulfonique. Cette voie électrochimique est régio et stéréosélective
(voir annexe 3). Seul un des deux stéréoisomères (-2-)
obtenus est représenté. L’électrolyse est réalisée dans une cellule non
divisée, avec une anode de carbone vitreux réticulé et une cathode de carbone.
L’électrolyte est une solution de perchlorate de lithium dans un mélange
méthanol/dichlorométhane 1:5 contenant de la 2,6-lutidine
(2,6-diméthylpyridine) à 0,4 mol.L-1 qui agit comme accepteur de
protons. Le courant est maintenu constant (12,9 mA) jusqu’à ce que 2,1 moles
d’électrons par mole de substrat (-1-) aient circulé.
Remarques :
- -OTBS correspond à un éther de
ter-butyldiméthylsilyle
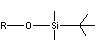
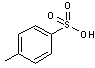
- TsOH correspond à l'acide
paratoluènesulfonique (ou APTS) encore appelé acide tosylique
La
réaction électrochimique mise en jeu ici est un processus de type
"Umpolung" qui permet le couplage de deux nucléophiles : éther d'énol
silylé et cycle furane.
- Bromure de tétra (n-butyle)
ammonium
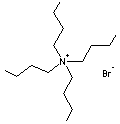
Umpolung
Ce
terme allemand désigne un changement de polarité d'un groupe fonctionnel.
Il
peut être obtenu par modification réversible du groupe fonctionnel ou par
application d'une tension électrique qui va permettre ce changement de polarité
(c'est ce qui se passe parfois dans les électrosynthèses).
Prenons
un exemple de modification réversible d'un groupe fonctionnel
(umpolung par intervention d'un réactif) :
- Le carbone d'un aldéhyde est
normalement polarisé positivement (d+) du fait de la présence d'un atome
d'oxygène plus électronégatif que lui.
![]()
Conséquence
: par réaction de ce composé carbonylé avec un réactif nucléophile, comme le
cyanure d'hydrogène par exemple, on obtient une cyanhydrine.
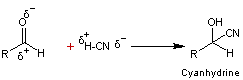
- Faisons réagir l'aldéhyde sur le
propane-1,3-dithiol on obtient un dithiane
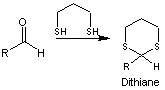
Le
dithiane remplace provisoirement le groupe carbonyle de départ.
L'hydrogène
lié au carbone fonctionnel peut être arraché sous forme de proton par le
n-butyllithium dans le THF à – 40°C
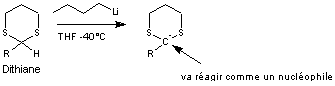
Le
carbone du groupe fonctionnel aldéhyde ainsi transformé en anion peut agir
comme nucléophile ; ainsi avec le bromure de benzyle on obtient :
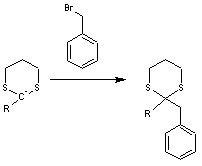
Par
hydrolyse on régénère le carbonyle
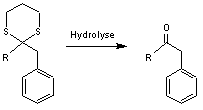
En
résumé la transformation provisoire du groupe carbonyle en dithiane à permis le
changement de polarité du carbone fonctionnel (Umpolung) et la formation d'un
composé qu'il aurait été difficile d'obtenir autrement.
Ce
concept a été introduit par James Corey et Dieter Seebach.
Régiosélectif
: c'est un carbone bien déterminé qui est mis en jeu.
Stéréosélectif
: la modification sur ce carbone peut se faire de deux façons, ce qui engendre
une stéréo-isomérie.