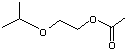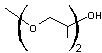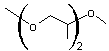ETHERS DE GLYCOL
Gérard GOMEZ
avec la collaboration de
Jacques BARON
Plan de
l'étude
1-1) Préliminaire
1-2) Formule générale des éthers de
glycol
2) Préparation des éthers de glycol
2-1) Ethers
monoalkylés
2-2) Ethers
esters
2-3) Ethers
dialkylés
3) Propriétés physiques générales des éthers de glycol
4-1) Des
dérivés de l'éthylène glycol
4-2) Des
dérivés du propylène glycol
5) Les utilisations des éthers de glycol
6-1) Voies
métaboliques des éthers de glycol
6-2) Risques
et mention de dangers pour quelques uns des éthers glycols mentionnés
6-3) Restriction
d'usage en France et en Europe
Annexe 1 Echelle de
Griffin
Annexe 2 Deux
hydrocarbures et des groupes qui leur correspondent
1-1) Préliminaire
: Ethers – Groupe méthylène – Ethylène – Propylène – Glycols – Ethers de glycol
simples
- Ethers
Dans une
nomenclature bien établie, les éthers sont des dérivés des alcools
![]()
- Groupes méthylène,éthylène, propylène
D'autre
part, les noms des groupes bivalents dérivant d'alcanes non ramifiés par
enlèvement d'un atome d'hydrogène à chacun des deux atomes de carbone terminaux
de la chaîne mettent en jeu le terme"méthylène". C'est le groupement
méthyle CH3- qui a perdu un hydrogène.
Exemple :
-CH2-CH2-CH2- est le groupe triméthylène
-CH2-CH2- devrait être le groupe diméthylène
; on lui donne le nom de groupe éthylène (voir annexe 2).
Il est important
de noter que le groupe
![]()
est appelé
"propylène".
- Glycols
Les glycols
sont des composés à deux fonctions alcool.
|
|
ou |
|
|
|
ou |
|
|
|
ou |
|
|
|
ou |
|
- Ethers de glycol simples
Les
structures des éthers les plus simples de l'éthylène glycol sont
|
|
ou |
Ethylène
glycol monoalkylé |
|
|
ou |
Ethylène
glycol dialkylé |
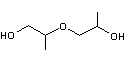
- Les structures des éthers les plus simples du propylène glycol sont
|
|
ou |
Propylène
glycol monoalkylé |
|
|
ou |
Propylène
glycol dialkylé |
Remarque :
La
désignation "monoalkylé", "dialkylé" peut parfois induire
en erreur ; ainsi la molécule suivante

et qui
possède 3 groupes méthyle pourrait faire penser à un dérivé trialkylé (en
l'occurrence triméthylé).
Il n'en est
rien il s'agit d'un propylène glycol dialkylé.
En effet on
ne compte pour les nommer que les groupes méthyle fixés à des atomes d'oxygène.
1-2) Formule
générale des éthers de glycol :
Un éther de
glycol répond à la formule générale suivante
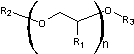
R2
correspond à un groupe alkyle (méthyle, éthyle, propyle, butyle ….)
- Si R1 correspond à H, on dit que l'éther glycol est un
dérivé de l'éthylène glycol (si n =1), du diéthylène glycol (si n = 2), du
triéthylène glycol (si n = 3).
- Si R1 correspond à CH3, on dit que l'éther
glycol est un dérivé du propylène glycol (si n =1), du dipropylène glycol
(si n = 2), du tripropylène glycol (si n = 3).
Ø Si R3
correspond à H on dit que l'éther glycol
est monoalkylé
Ø Si R3
correspond à CH3 on dit que l'éther glycol est dialkylé
Exemples :
|
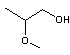
- A
- |
|
n = 1 R1 = H C'est un dérivé de l'éthylène glycol R2 = CH3 groupe méthyle R3 = H Ether glycol
monoalkylé |
Acronyme et noms EGME : Ethylène Glycol Méthyl
Ether Ou 2-méthoxyéthanol |
|
- B
- |
|
n = 2 R1 = H C'est un dérivé du diéthylène glycol R2
= CH3-CH2 groupe éthyle R3 = H Ether glycol
monoalkylé |
Acronyme et noms DEGEE : DiEthylène Glycol
Ethyl Ether Ou 2-(2-Ethoxyéthoxy)-éthanol |
|
- C
- |
|
n = 1 R1 = H C'est un dérivé de l'éthylène glycol R2 = CH3 groupe méthyle R3 = CH3
Ether glycol dialkylé |
Acronyme et noms EGDME : Ethylène Glycol
DiMéthyl Ether Ou 1,2-diméthoxyéthane |
|
- D
- |
n = 1 R1 = CH3 C'est un dérivé du propylène glycol R2
= CH3 –CH2-CH2-CH2 groupe butyle R3 = H Ether glycol monoalkylé |
Acronyme et noms 2PG1BE : 2-Propylène Glycol
1-n-Butyl Ether Ou 1-butoxypropan-2-ol |
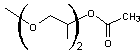
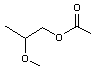
Remarque : Ethers esters
Les
acétates des composés monoalkylés sont aussi des éthers de glycol ; ainsi les
acétates des composés des exemples - A -, - B -, - D -, sont des éthers de
glycol
|
- A' - |
|
|
- B' - |
|
|
- D' - |
|
On dit
d'eux que ce sont des éthers esters.
2)
Préparation des éthers de glycol
2-1) Ethers
monoalkylés
On peut
les préparer en faisant réagir un oxirane sur un alcool
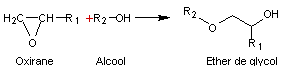
Exemple
1 :
Préparation
de l'EGME, un éther d'éthylène glycol
![]()
Exemple
2 :
Préparation
du 2PG1BE, un éther de propylène glycol
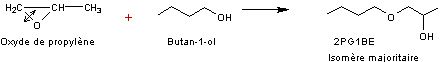
L'ouverture
de la liaison C-O de l'oxirane a lieu surtout du côté le moins encombré.
Remarque :
Cette
synthèse conduit à un autre composé, isomère minoritaire qui correspond à
l'ouverture du C-O de l'oxirane de l'autre côté
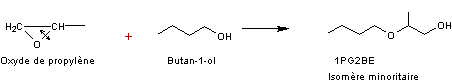
Par
réaction de l'acide acétique (ou d'un autre acide carboxylique) sur un éther de
glycol monoalkylé on obtient l'acétate (ou le carboxylate) de cet éther.
Exemple
1 :
Préparation
de l'acétate de EGME
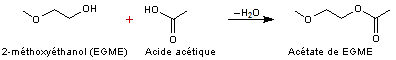
Exemple
2 :
Préparation
de l'acétate de 2PG1BE
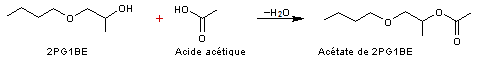
Ils
peuvent être synthétisés par alkylation des éthers de glycol monoalkylés par
des agents alkylants comme les dialkylsulfates
Exemple :
Préparation
de l'EGDME par alkylation de l'EGME par le sulfate de diméthyle
![]()
3)
Propriétés physiques générales des éthers de glycol :
Ce sont
des liquides légèrement visqueux, incolores, à odeur légère d'éther,
moyennement volatils. Ils sont inflammables et leurs vapeurs peuvent former des
mélanges explosifs avec l'air.
Un
caractère important au regard des applications qui en découlent est qu'ils sont
amphiphiles c'est-à-dire à la fois hydrophiles et lipophiles.
L'hydrophilie
est liée à la présence pour la plupart d'entre eux d'une fonction alcool,
polaire, tandis que le caractère lipophile est dû à la présence d'une chaîne
carbonée non polaire.

A noter
que le caractère hydrophile est plus marqué que le caractère lipophile pour la
plupart des éthers glycol (voir annexe 1).
Ceux
dont la chaîne alkyle est constituée de moins de 4 atomes de carbone sont
miscibles à l'eau en toutes proportions.
Les
propriétés amphiphiles des éthers de glycol en font d'excellents cosolvants
eau-huile permettant de mélanger entre elles des substances non miscibles comme
des cires ou des résines et plus généralement des composés organiques, dans une
matrice aqueuse.
4)
Quelques éthers de glycol :
Leur
utilisation dans l'industrie a commencé dans les années 1930 et s'est surtout
développée dans les années 1960 ; ils ont permis l'avènement des peintures dites
à l'eau qui ont remplacé les peintures à solvants aromatiques inflammables et
neurotoxiques.
Ce sont
les dérivés de l'éthylène glycol, synthétisés à partir de l'oxyde d'éthylène,
un sous-produit de l'industrie pétrolière, qui ont surtout été mis en œuvre
jusque dans les années 1990 ; mais on s'est aperçu que ces solvants étaient eux-mêmes toxiques ; ils ont
alors été remplacés par des éthers de glycol dérivés du propylène glycol dont
la toxicité est bien moindre.
4-1) Des dérivés
de l'éthylène glycol (composés de la série E)
|
EGME (n° CAS 109-86-4) |
EGMEA (n° CAS 110-49-6) |
EGDME (n° CAS 110-71-4) |
DEGME (n° CAS 111-77-3) |
|
DEGDME (n° CAS 111-96-6) |
TEGME (n° CAS 112-35-6) |
TEGDME (n° CAS 112-49-2) |
EGEE (n° CAS 110-80-5) |
|
EGEEA (n° CAS 111-15-9) |
EGDEE (n° CAS 629-14-1) |
DEGEE (n° CAS 111-90-0) |
DEGEEA (n° CAS 112-15-2) |
|
DEGDEE (n° CAS 112-36-7) |
TEGEE (n° CAS 112-50-5) |
EGnPE (n° CAS 2807-30-9) |
EGnPEA (n° CAS 20706-25-6) |
|
|
|||
|
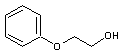
EGiPE (n° CAS 109-59-1) |
EGiPEA (n° CAS 15234-20-98) |
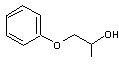
EGPhE (n° CAS 122-99-6) |
EGBE (n° CAS 111-76-2) |
|
EGBEA (n° CAS 112-07-2) |
DEGBE (n° CAS 112-34-5) |
DEGBEA (n° CAS 124-17-4) |
TEGBE (n° CAS 143-22-6) |
|
|||
|
EGHE (n° CAS 112-25-4) |
DEGHE (n° CAS 112-59-4) |
|
|
Remarque : A titre d'exemple,
on peut développer la formule d'un dérivé du diéthylène glycol à savoir le DEGBE (DiEthylène
Glycol Butyl Ether)
|
C8H18O3 |
|
ou |
4-2) Des
dérivés du propylène glycol (composés de la série P)
|
2PG1ME (n° CAS 107-98-2) |
2PG1MEA (n° CAS 108-65-6) |
PGDME (n° CAS 7778-85-0) |
DPGME (n° CAS 34590-94-8) |
|
DPGMEA(n° CAS 88917-22-0) |
DPGDME (n° CAS 111109-77-4) |
TPGME (n° CAS 25498-49-1) |
1PG2ME (n° CAS 1589-47-5) |
|
|
|
|
|
|
1PG2MEA (n° CAS 70657-70-4) |
2PG1EE (n° CAS 1569-02-4) |
2PG1EEA (n° CAS 54839-24-6) |
DPGEE (n° CAS 300025-38-8) |
|
|
|
|
|
|
2PG1PhE (n° CAS 770-35-4) |
2PG1BE (n° CAS 5131-66-8) |
DPGBE (n° CAS 24083-03-2) |
TPGBE (n° CAS 55934-93-5) |
|
|||
|
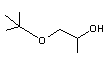
PGMtBE (n° CAS 57018-52-7) |
|
||
5)
Les utilisations des éthers de glycol
Les
plus utilisés en Europe sont les suivants
EGBE, 2PG1ME, EGBEA, EGPhE, DEGME, DEGEE, DEGBE,
DEGBEA, TEGME, 2PG1MEA, PG1EE.
Les
domaines d'utilisation sont variés :
(Source
: "Les éthers de glycol dans les produits de consommation et la santé –
Rapport d'avancement au Directeur Général de la santé (groupe d'experts) –
2001)
- Les peintures de tout type
(avions, automobiles, bâtiment …) mais aussi les laques, les colorants,
les encres et les vernis
Ø
EGBE et 2PG1ME : agents de tension qui
retardent l'évaporation de l'eau et augmentent le temps permettant une
application de qualité.
Ø
DEGBE et DPGBE : agents de coalescence
dans les peintures de latex ; permettent
la fusion des particules de latex pour que se fasse correctement un film de
liant.
Ø
TPGBE qui joue le rôle d'agent de
compatibilité entre molécules insolubles et le "véhicule" aqueux.
·
Les produits d'entretien et de
nettoyage
Ø
EGBE, 2PG1ME et PGPhE sont présents dans des
produits de lavage de vitres, liquides vaisselle et nettoyants multi-usages.
Ø
EGPhE dans les lingettes pour bébés.
- Les teintures et impression des textiles et le finissage
du cuir
Ø
DEGDME ou EGBEA.
- Les produits phytopharmaceutiques (fongicides par
exemple)
Ø
DEGBE, 2PG1ME, DPGME.
- Les colles, les adhésifs polymères
Ø EGBE, 2PG1ME, 2PG1EE, EGEE, DEGME, DPGME.
- Les fluides de coupe (fraisage,
tournage, rabotage)
Ø
EGEE, DEGEE, EGBE, DEGBE,
- Les liquides de frein
Ø
DEGDME, DEGEE, DEGBE sont utilisés comme
diluants.
- Produits cosmétiques
Ø
DEGEE qui sert de solvant solubilisant
Ø
EGPhE qui sert de conservateur
Ø
EGBE, DEGBE des solvants
utilisés pour la coloration capillaire.
- Produits lave-glace
Ø
EGBE
- Antigel des carburants pour avions
Ø
EGME, DEGME.
- Intermédiaires de synthèse
par exemple dans la préparation
d'agents tensioactifs polyéthoxylés.
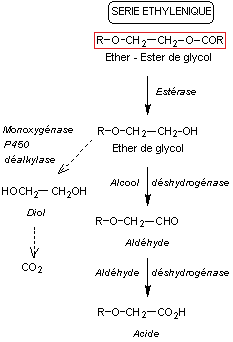
6-1) Voies
métaboliques des éthers de glycol
Ces
composés pénètrent assez facilement dans l'organisme par voie orale, pulmonaire
ou cutanée.
Après
quelques heures on en retrouve en concentration non négligeable dans le foie,
les reins, les graisses, mais aussi dans la moelle osseuse, la vessie, la rate.
Il y a
peu d'élimination dans les urines sous forme inchangée (moins de 10%).
Ils
subissent un métabolisme très rapide, différent selon que l'on a des éthers de
glycol de la série éthylénique ou de la série propylénique comme on le voit sur
les schémas ci-dessous
|
|
|
|
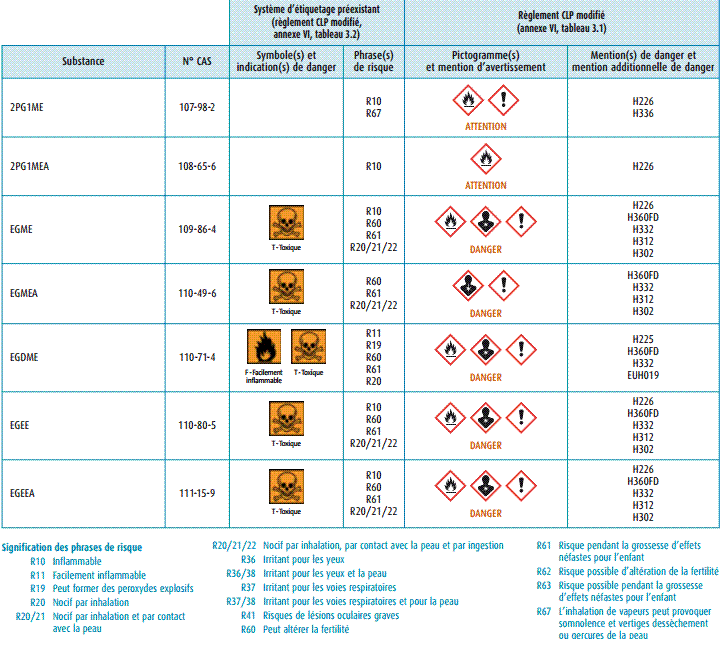
6-2) Risques et
mention de dangers pour quelques uns des éthers glycols mentionnés
Le
tableau ci-dessous (document
INRS fiche ED 4222 2ème édition – juin 2011) récapitule les dangers
et les risques qu'entraîne l'utilisation de certains de ces composés. Il ne
s'agit pas d'une étude exhaustive.
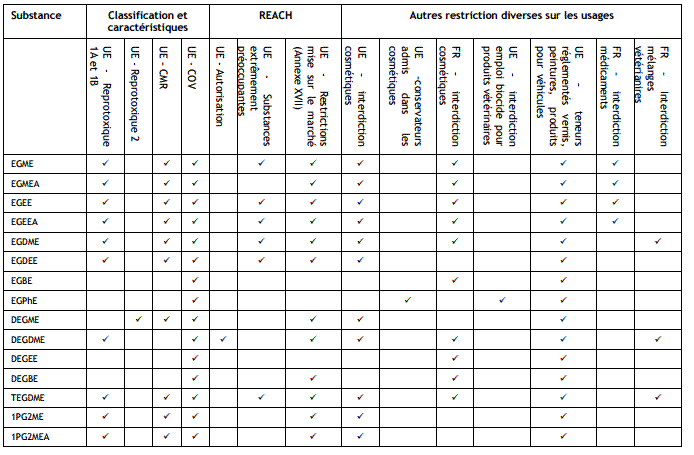
6-3) Restriction
d'usage en France et en Europe
On
trouvera dans le tableau ci-dessous un résumé de quelques risques que présente
l'utilisation de certains de ces éthers de glycol et quelques restrictions
d'usage en France et en Europe
Source : INERIS (Données
technico-économiques sur les substances chimiques en France) 06/11/2015
Echelle de Griffin
On attribue à chaque amphiphile un nombre compris
entre 1 et 20, l'ensemble constituant l'échelle de Griffin. Ce nombre est
appelé indice HLB (Hydrophilic/Lipophilic Balance)
l'indice 1 est donné à l'acide oléique et l'indice 20 à l'oléate de potassium.
Cette échelle permet d'apprécier le caractère plutôt
lipophile ou au contraire plutôt hydrophile d'un amphiphile et de savoir pour
quelle application il est le mieux adapté.
·
Un indice HLB inférieur à 9 fera dire de
l'amphiphile qu'il est lipophile ; on l'utilisera alors comme agent
antimousse (si HLB<3), comme émulsifiant de l'eau dans l'huile (si
3<HLB<6) et comme agent mouillant au-delà.
·
un indice supérieur à 11 qu'il est hydrophile
; on l'utilisera comme émulsifiant de l'huile dans l'eau (si 9<HLB<13),
comme détergent (si 13<HLB<15) et comme solubilisant au delà.
Calcul
d'un HLB
Exemple
1
Prenons
l'exemple du DEGHE (DiEthylène Glycol Hexyl Ether)
![]()
La
partie lipophile de cette molécule est constituée par la chaîne hydrocarbonée
CH3-(CH2)5- (de masse molaire 85 g.mol-1)
et la partie hydrophile par le reste de la molécule (de masse molaire 105 g.mol-1).
La masse molaire de l'ensemble de la molécule d'amphiphile étant 190 g.mol-1.
L'indice
HLB s'obtient par la formule :
HLB =
20x(masse molaire de la partie hydrophile)/(masse molaire de l'ensemble de la
molécule). Soit numériquement :
HLB =
20x105/190 = 11,0
On voit
que cet éther de glycol est hydrophile et peut être utilisé comme émulsifiant
de l'huile dans l'eau.
Exemple
2
Prenons
l'exemple du TPGME
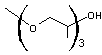
La
partie lipophile de cette molécule est constituée par la chaîne hydrocarbonée
CH3-(de masse molaire 15 g.mol-1) et la partie hydrophile
par le reste de la molécule (de masse molaire 191 g.mol-1). La masse
molaire de l'ensemble de la molécule d'amphiphile étant 206 g.mol-1.
HLB =
20x191/206 = 18,5
On voit
que cet éther de glycol est hydrophile et peut être utilisé comme solubilisant.
Deux
hydrocarbures et des groupes qui leur correspondent
|
Hydrocarbure |
Groupe hydrocarboné bivalent |
|||
|
Nom officiel |
Nom usuel |
Formule |
Nom |
Formule |
|
Ethène |
Ethylène |
|
Ethylène |
|
|
Propène |
Propylène |
|
Propylène |
|