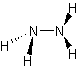
HYDRAZINE
Extrait du
sujet de chimie (option physique) de l'agrégation de chimie 2020
L’hydrazine, de formule N2H4,
est, à température ambiante, un liquide incolore cancérogène et toxique pour
les organismes aquatiques mais qui ne répond pas aux critères environnementaux
de persistance et de bioaccumulation.
Son odeur
est comparable à celle de l'ammoniac. L'hydrazine est un composé inflammable,
extrêmement corrosif et irritant.
L'hydrazine
est principalement utilisée sous forme d'hydrate de formule N2H4.H2O.
L'hydrate d'hydrazine a été synthétisé pour la première fois en 1889 par
Theodor Curtius, un chimiste allemand.
Actuellement, sa production mondiale
annuelle est estimée à plus de 50 000 tonnes. L’hydrate d’hydrazine est utilisé
majoritairement comme agent gonflant pour les mousses de polymères (PE, PVC,
PMMA, caoutchouc…) et comme inhibiteur de corrosion dans les chaudières
industrielles, dans les centrales nucléaires et thermiques. L'hydrate
d’hydrazine est également un important intermédiaire en synthèse organique
industrielle et en chimie fine. En particulier l’hydrazine est utilisée dans la
réduction de Wolff-Kishner, une réaction qui transforme le groupe carbonyle
d’une cétone ou d’un aldéhyde en groupe méthylène ou en groupe méthyle.
On retrouve également des motifs
dérivés de l'hydrazine dans de nombreux composés avec des applications
thérapeutiques (comme la carbidopa) ou des pesticides. Le secteur de
l’aérospatial est le plus gros consommateur d’hydrazine pure. En effet, si dès
la fin de la seconde guerre mondiale, l'hydrate d'hydrazine a été utilisé comme
carburant dans le premier avion de chasse à réaction, l’hydrazine pure et ses
dérivés méthylés sont utilisés depuis plus de 50 ans comme propergol en
association avec le tétraoxyde de diazote N2O4 dans les
fusées (notamment Ariane) ; l’hydrazine est utilisée généralement seule comme
monergol dans les moteurs à faible poussée (mais grande précision) permettant
le positionnement sur orbite des satellites et des sondes spatiales. Par
exemple, les moteurs de fusée pour la descente de la sonde spatiale de la
mission InSight sur la planète Mars en 2018 fonctionnaient avec l’hydrazine
comme seul ergol. Dans ce cas, la poussée est assurée par décomposition
catalytique de l’hydrazine modélisée par l’équation de réaction :
N2H4(l)
= N2(g) + 2 H2(g)
Enfin, il a
été récemment mis en évidence que l'hydrazine est un métabolite de certaines
bactéries. En particulier, l'hydrazine est produite par certaines bactéries
pendant le processus dit "annamox" (de l'anglais anaerobic ammonium
oxidation). Ce processus permet la conversion de l’ion ammonium en diazote
gazeux en utilisant l’ion nitrite comme accepteur d’électrons. Il est notamment
reconnu comme ayant une grande importance dans le cycle de l’azote en milieu
marin (30 à 50 % de l’azote moléculaire produit par les océans proviendrait de
ce processus) et dans le domaine du traitement des eaux usées et en particulier
pour l'élimination des engrais azotés.
Une
synthèse de l'hydrazine
La synthèse
de l’hydrazine s’effectue principalement selon le procédé Raschig.
Ce procédé
se déroule en deux étapes :
- la première étape, instantanée, consiste
en la formation de monochloramine par réaction d’une solution aqueuse
d’hypochlorite de sodium (Na+(aq) +
ClO−(aq)) sur un excès d’ammoniac (rapport molaire 1/30).
![]()
- La deuxième étape est la réaction
en milieu basique de la monochloramine avec l’excès d’ammoniac.
![]()
La
transformation qui s’effectue en solution aqueuse est modélisée par l’équation
:
![]()
Le
rendement obtenu est de 60 % et conduit à l’obtention d’une solution aqueuse
contenant environ 0,5 % en masse d’hydrazine.
Hydrazine ou diazane
Remarque : il s'agit d' un composé
inorganique
|
Formule N2H4 |
NH2-NH2
|
|
Aspect |
Liquide
hygroscopique, incolore, fumant, d'odeur comparable à celle de l'ammoniac. |
|
Masse
molaire |
32,045
g.mol-1 |
|
Fusion |
2°C |
|
Ebullition |
114°C |
|
Densité |
1,010 |
|
Indice de
réfraction |
1,469 |
|
Solubilité |
Miscible à
l'eau et aux solvants organiques polaires |
|
N° CAS |
301-01-2 |