LE
DIOXYDE DE CARBONE, UN SYNTHON (Voir annexe 2)
Différentes synthèses des
polycarbonates
Extrait
du sujet du concours Agro-Veto de 2015
Plan de l'étude
1) Synthèse des
polycarbonates par la voie phosgène
2) Synthèse de
polycarbonates par copolymérisation du dioxyde de carbone avec les époxydes
3) Synthèse des
polycarbonates par le procédé Asahi Kasei
Annexe 1 Le
phosgène
Annexe 2
Notion de synthon
Annexe 3 Précisions
sur la copolymérisation par insertion de
l'époxyde et du dioxyde de carbone
Annexe 4 Une
réaction parasite
Annexe 5
Equation de réaction d'un organo-magnésien mixte sur un époxyde
La synthèse de polymères utilisant
le dioxyde de carbone comme matière première représente une voie originale qui
s’inscrit dans une démarche de chimie durable : en raison de son faible coût et
de sa faible toxicité, le dioxyde de carbone est en effet une source de carbone
intéressante pour les procédés de synthèse industriels, d’autant plus qu’étant
un composé gazeux il présente l’avantage d’être compatible avec de nombreux
procédés de polymérisation existant. L’un des débouchés qui fait actuellement
l’objet de nombreux travaux de recherche concerne l’utilisation du dioxyde de carbone
en tant que réactif dans la synthèse des polycarbonates.
1)
Synthèse des polycarbonates par la voie phosgène
Le
principal polycarbonate commercial est le polycarbonate de bisphénol A. C’est
une matière plastique transparente, résistante aux chocs et utilisable dans une
large gamme de températures ce qui en fait un matériau de choix dans la
fabrication de nombreux objets : verres de vue, fenêtres, CD et DVD, vitres de
phares automobiles, etc. La méthode la plus utilisée actuellement pour la
fabrication du polycarbonate de bisphénol A est la polycondensation du
bisphénol A et du phosgène COCl2 (voir annexe 1)
en présence de soude : le procédé industriel fait réagir le sel disodique de
bisphénol A avec le phosgène dissous dans un solvant organique chloré comme le
dichlorométhane CH2Cl2. Ce procédé comporte de nombreux
inconvénients parmi lesquelles l’extrême toxicité du phosgène, l’utilisation de
solvant à faible point d’ébullition et l’obtention d’une grande quantité d’eau
usée contenant du dichlorométhane et du sel qui doit ensuite être traitée.
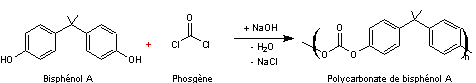
La
molécule de phosgène COCl2 présente une réactivité chimique
similaire à celles de la famille des chlorures d’acyle.
2)
Synthèse
de polycarbonates par copolymérisation du dioxyde de carbone avec les époxydes
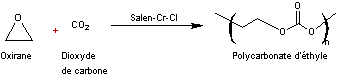
L’utilisation
du dioxyde de carbone comme réactif dans la synthèse des polycarbonates fournit
une alternative plus économique et moins toxique à l’utilisation du phosgène ;
de plus cette voie de synthèse est susceptible de valoriser des quantités
importantes de dioxyde de carbone. La copolymérisation du dioxyde de carbone
avec les époxydes se déroule selon un mécanisme de coordination-insertion qui
met généralement en œuvre un catalyseur de type complexe organométallique
(LM-X) jouant le rôle d’un acide de Lewis.
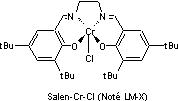
Le
catalyseur noté salen-Cr-Cl est représenté ci-dessous
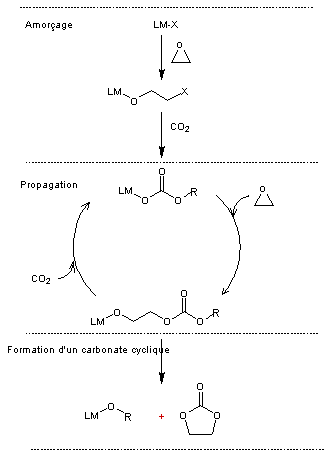
La
formation du polymère est généralement accompagnée de la production de
carbonate cyclique à cinq centres. Les catalyseurs mis en œuvre pour la
copolymérisation époxyde-CO2 sont essentiels à la fois pour
contrôler la sélectivité de la réaction (selon le catalyseur utilisé, la
proportion de carbonate cyclique fabriqué peut varier de 1 à 99%) et pour
limiter les réactions parasites (voir annexe 4) afin
d’obtenir des polymères de masse molaire élevée. Le mécanisme de
copolymérisation époxyde-CO2 est représenté ci-dessous. La
réactivité du catalyseur LM-X et des intermédiaires de type LM-OR (voir annexe 3) est analogue à la réactivité d’un organomagnésien
mixte. Par exemple, le mécanisme de la première étape de l’amorçage est
analogue à celui de l’action d’un organomagnésien sur l’oxirane (voir annexe 5).
3)
Synthèse des polycarbonates par le procédé Asahi Kasei
Le
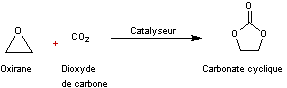
carbonate cyclique n’est pas uniquement un produit indésirable de la réaction
de polymérisation. Un procédé développé par la société japonaise Asahi Kasei utilise
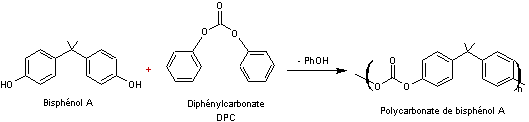
justement le carbonate cyclique obtenu par addition du dioxyde de carbone sur
l’oxirane comme matière première pour produire du diphénylcarbonate (PhO)2CO,
qui remplace avantageusement le phosgène COCl2 dans la production du
polycarbonate du bisphénol A.
Les
avantages du procédé Asahi Kasei sont nombreux : premièrement il permet de
s’affranchir de l’utilisation du phosgène COCl2 et de
dichlorométhane pour la synthèse du polycarbonate, deuxièmement les produits
obtenus – polycarbonate et éthylène glycol – sont extrêmement purs car non
contaminés par les dérivés halogénés issus de l’utilisation du phosgène, et
troisièmement les intermédiaires de synthèse utilisés – le méthanol MeOH et le
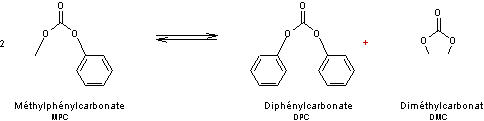
phénol PhOH – sont entièrement recyclés au cours du processus ci-dessous :
Formation du carbonate cyclique
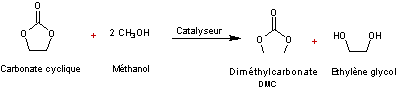
Formation du diméthylcarbonate
Formation du diphénylcarbonate (DPC)
- I -
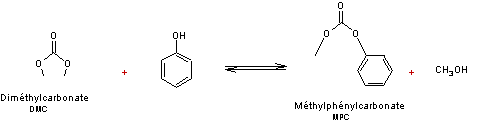
- II –
Le
phosgène ou chlorure de carbonyle ou dichlorure de méthanoyle (COCl2)
![]()
est
un gaz très toxique, utilisé dans certaines synthèses (polyuréthanes,
isocyanates et ici polycarbonates) qui se forme par réaction du dichlore sur le
monoxyde de carbone
![]()
Il
a été utilisé comme arme chimique notamment pendant la première guerre
mondiale.
Notion de synthon (building block en
anglais)
Il s'agit d'une entité moléculaire
mise en oeuvre dans la synthèse d’une molécule afin d’y introduire un motif
structural donné.
Le terme trouve son origine dans la
méthode dite de l’« analyse rétrosynthétique », qui consiste à concevoir un
chemin de synthèse d’une molécule en la considérant comme la combinaison de
fragments plus simples, réels ou hypothétiques, appelés « synthons », qui sont
traduits ensuite en réactifs servant de points de départ à la synthèse réelle,
souvent une synthèse combinatoire.
Précisions sur la
copolymérisation par insertion de
l'époxyde et du dioxyde de carbone entre le métal et l'atome d'oxygène.

Une réaction parasite
En présence d'un composé protique
(R'-OH) par exemple de l'eau ou un alcool, il peut se produire une réaction
parasite qui influe sur la longueur de la chaîne du polymère obtenu :
![]()
Equation de réaction d'un
organo-magnésien mixte sur un époxyde
![]()