PLUIES ACIDES
Article inspiré par le sujet du concours général des
lycées 2021 ; il en contient un large extrait.
L'eau
de pluie présente une acidité naturelle. Cette acidité provient de la présence
de dioxyde de carbone CO2 (g) dans l'atmosphère qui se
dissout dans l'eau des nuages sous forme d'acide carbonique H2CO3
(aq). La présence de cet acide en
solution conduit à une eau de pluie dont le pH est naturellement égal à environ
5,6.
On
observe parfois des précipitations beaucoup plus acides, on parle alors de
pluies"acides". L'acidification supplémentaire des eaux de pluie
provient d'une pollution atmosphérique locale. Les pollutions à
l'"azote" (NOx*(g)) ou au "soufre" (SO2(g),
SO3(g)) sont des causes majeures d'acidification des eaux de
pluie par formation respectivement d'acide nitrique et d'acide sulfurique une
fois dissous dans l'eau des nuages.
1) Mécanisme
d'acidification d'une eau de pluie lors d'une pollution au dioxyde d'azote NO2*(g)
Remarque : Le signe * signifie
que cette molécule est un radical, c'est-à-dire qu'elle possède un électron
célibataire lui conférant une grande réactivité. Le dioxyde d'azote gazeux est
transformé en acide nitrique dans l'atmosphère suivant deux mécanismes ayant
lieu en phase gazeuse, l'un se déroulant de jour et l'autre de nuit.
- De jour :
NO2*(g) + HO*(g) + M ------>
HNO3 (g) + M
- De nuit :
NO2*(g) + NO3*(g) + M
------> N2O5 (g) + M
N2O5
(g) + H2O (g)
------> 2 HNO3 (g)
où M
est une impureté.
On voit
que la formation diurne implique le radical hydroxyde HO*(g)
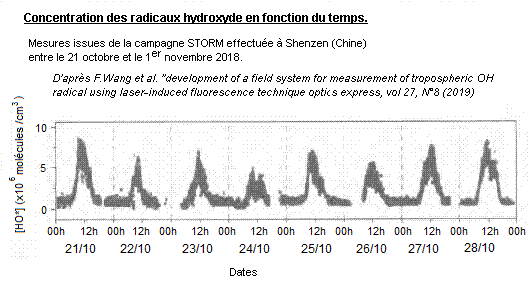
Formation du radical hydroxyde
dans l'atmosphère
La
formation de l'acide nitrique HNO3 (g) lors de la journée met
en jeu le radical hydroxyde HO*(g) qui se forme à partir de l'ozone
atmosphérique O3 (g) selon le mécanisme :
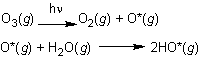
où
hν représente l'énergie d'un photon absorbé par la molécule d'ozone.
2) Mécanisme
d'acidification d'une eau de pluie lors d'une pollution au dioxyde de soufre
Il met
aussi en jeu le radical hydroxyle HO*
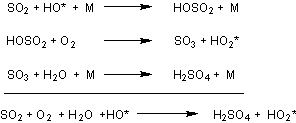
HO2*
disparaît lors de la rencontre d'une molécule NO dans l'atmosphère
![]()
Avec ce
nouveau radical HO* les processus se poursuivent.