DEUX HYPOLIPIDEMIANTS *
Deux molécules anti-cholestérol
Plan de l'étude
1) Généralités
2)
Mode d'action des hypolipidémiants
2-1)
Voie métabolique simplifiée du cholestérol
2-2)
La lovastatine
Quelques notions sur les inhibiteurs
d'enzymes
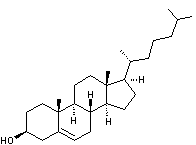
Dans les pays industrialisés, le
traitement des maladies coronariennes est un enjeu majeur car celles-ci
induisent une mortalité supérieure à l’ensemble des cancers. Dès la fin du XXe
siècle, des efforts considérables ont visé à identifier des traitements
efficaces et minimisant les effets secondaires. Une cible majeure est
l’athérosclérose, liée principalement à des accumulations de dépôts gras
(athérome), réduisant l’efficacité de la circulation sanguine (en diminuant les
qualités élastiques des parois artérielles) et accélérant le vieillissement du
cœur. Ces accumulations sont en particulier liées à des taux élevés de
cholestérol, apporté par l’alimentation mais aussi par biosynthèse dans le foie
:
|
|
|
Formule du
cholestérol |
Une avancée importante a reposé sur
le développement de médicaments permettant un contrôle ciblé de la formation du
cholestérol.
Cet article porte sur deux de
ceux-ci :
-
L'acide zaragozique
-
La lovastatine
2) Mode d'action des
hypolipidémiants
Les médicaments interviennent dans
l’organisme au niveau des voies métaboliques de production de certaines
espèces. Par exemple l’aspirine est un anti-inflammatoire non stéroïdien qui
inhibe la production de prostaglandines (agents de signalisation de l’organisme
provoquant une inflammation locale), par interaction avec deux enzymes qui
permettent leur production. Pour qu’un médicament soit efficace avec un minimum
de nocivité, il faut qu’il agisse sur la production d’une espèce responsable de
la pathologie que l’on souhaite traiter, sans intervenir dans la production
d’autres espèces.
2-1) Voie métabolique simplifiée du cholestérol

Il a
été indiqué sur le schéma ci-dessus qui représente une voie métabolique
simplifiée du cholestérol les points précis d'action des deux hypolipidémiants,
la lovastatine et l'acide zaragozique :
- La lovastatine agit au
niveau de l'enzyme HMG CoA réductase qui permet l'obtention d'acide mévalonique
- L'acide zaragozique
agit au niveau de l'enzyme squalène synthase qui permet de transformer le
farnésyl pyrophosphate en présqualène pyrophosphate.
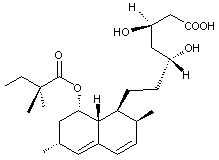
La lovastatine, présente
à l’état naturel dans un champignon (le pleurote en huître) et dans la levure
de riz rouge, est le principe actif du Mevacor®, médicament (statine) toujours
commercialisé dans certains pays comme le Canada, les Etats-Unis et l’Espagne.
La molécule provoque chez les patients traités un abaissement notable du taux
de cholestérol.
Comme
toutes les statines c'est un inhibiteur compétitif (voir annexe 1) de l'enzyme 3-hydroxy-3-méthylglutaryl coenzyme A réductase
(HMG-CoA réductase ) qui est l'enzyme qui contrôle la voie du mévalonate qui,
entre autres devenirs, mène à la biosynthèse du cholestérol et
d'autres isoprénoïdes ; en inhibant cette enzyme, il y a une diminution de
la synthèse de l'acide mévalonique (plus de 80%) et par voie de conséquence de
celle du cholestérol.
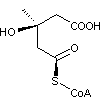
La comparaison des
structures de l'HMG-CoA et de la lovastatine permet de comprendre pourquoi il y
a compétitivité de ces deux molécules lors de la synthèse de l'acide
mévalonique :
|
|
|
|
HMG-CoA |
Lovastatine |
En
formant de manière réversible avec l'enzyme HMG-CoA réductase un ensemble inactif,
elle ralentit son activité. C'est un inhibiteur compétitif réversible efficace.
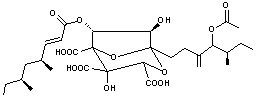
Cette
molécule permet un contrôle ciblé de la formation du cholestérol dans
l'organisme ; elle ralentit l'activité de l'enzyme squalène synthétase (ou
synthase), en formant de manière réversible un adduit inactif avec cet enzyme
nécessaire au métabolisme du cholestérol. C'est un inhibiteur compétitif efficace.
Elle
fait partie d'une famille de molécules naturelles produites par deux
champignons : Sporomielle intermedia et L. elatius. N'étant
accessible qu'en petite quantité via ces champignons, il a été nécessaire de
mettre au point sa synthèse totale.
Quelques
notions sur les inhibiteurs d'enzymes
Ce
sont des substances qui, en se liant aux enzymes, empêchent la fixation des
substrats sur leur site de fixation ou inactivent les enzymes ; ce faisant ils
diminuent leur pouvoir catalytique.
On
distingue plusieurs types d'inhibiteurs parmi lesquels nous distinguerons les
compétitifs et les incompétitifs.
- Les inhibiteurs compétitifs
:
En
général ces molécules ont une structure géométrique proche de celle du substrat
(analogue isostérique). Elles se lient à l'enzyme en lieu et place du substrat
; n'ayant pas par ailleurs les fonctions chimiques de celui-ci, elles bloquent
la réaction enzymatique.
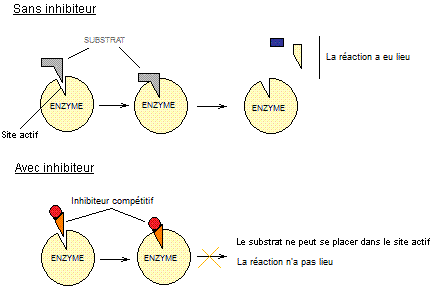
Remarque :
Parfois
l'inhibiteur n'occupe pas le site actif mais un autre site de l'enzyme appelé
site allostérique ; cela entraîne la déformation du site actif et le substrat
ne peut se lier à l'enzyme ; la réaction enzymatique ne peut avoir lieu.

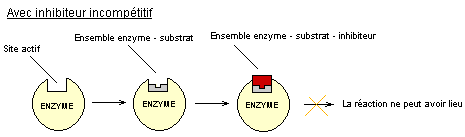
- Les inhibiteurs incompétitifs
Ils
ne se lient pas à l'enzyme seule mais à l'ensemble enzyme – substrat et
bloquent la réaction enzymatique.
* Article bâti autour du sujet de chimie du
concours d'admission 2020 aux Ecoles Normales Supérieures ; il en contient des
extraits.