LE
GraphENE – NANOTUBES DE CARBONE
Plan de l'étude
1) Le graphène
1-1) Structures
cristallographiques du carbone
1-2) Production
du graphène par CVD
1-2-1) Production
1-2-2) Caractérisation
1-3) Exfoliation
du graphite par fonctionnalisation du graphène selon la réaction de Diels-Alder
1-4) Une
application du graphène
2-1)
Structure
2-2) Propriétés
2-3) Préparation des nanotubes de carbone
2-4) Remarque
Annexe 1 Notion de "gap"
1) Le graphène (D'après le sujet de
chimie concours commun mines-ponts 2022)
Le
graphène a été découvert en 2004 par deux physiciens russes, A. Geim et K.
Novoselov, ce qui leur a valu le prix Nobel de physique en 2010. Ce nouveau matériau,
issu du carbone graphite, présente des propriétés extraordinaires. Sa mobilité
électronique 120 fois supérieure à celle du silicium, sa très grande
conductivité thermique, sa résistance mécanique et sa transparence font de lui
un matériau aux applications prometteuses.
1-1) Structures
cristallographiques du carbone
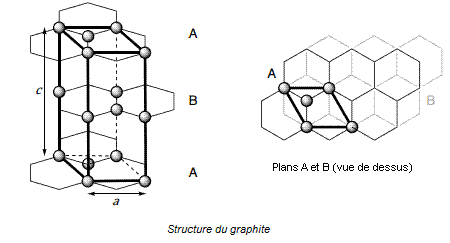
Le
graphène est préexistant dans le graphite. En effet, la structure du graphite
est un empilement de plans décalés de graphène tenus entre eux par des forces
de Van der Waals. Dans cet empilement, la moitié des atomes des hexagones du
plan B sont positionnés au-dessous des centres des hexagones du plan A.
|
|
|
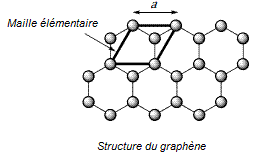
On
considère dès lors l’arrangement bidimensionnel d’atomes de carbone d’épaisseur
monoatomique disposés suivant un réseau dit en « nid d’abeilles ». La structure
cristallographique du graphène peut être décrite par la cellule unitaire en
gras.
1-2) Production du
graphène par CVD (Chemical Vapor Deposition)
Historiquement,
c’est par exfoliation mécanique que Novoselov et Geim ont isolé le graphène
pour la première fois en 2004 : à l’aide d’un papier collant type « scotch »,
ils ont réussi à séparer les feuillets du graphite et obtenu des couches de
graphène sur l’adhésif. Mais cette méthode n’est pas efficace pour une
production industrielle. Les chimistes se sont tournés vers une autre voie, le
dépôt chimique en phase vapeur ou CVD.
La
méthode, qui s’avère aujourd’hui la plus efficace, est le dépôt chimique sur le
cuivre, ce catalyseur ne formant pas de solution solide avec le carbone en
dessous de 1000 °C.
1-2-1) Production
Le
principe de base consiste à introduire dans un four un précurseur de carbone
sous forme gazeuse, comme le méthane, et un gaz comme le dihydrogène qui est
utilisé pour préparer la surface de dépôt et pour diluer le gaz précurseur,
ceci permettant de réguler la vitesse de croissance du graphène.
Le
dépôt chimique peut être schématisé par :
![]()
puis
![]()
Le
méthane est porté à très haute température en présence d’un substrat
métallique, du cuivre la plupart du temps. Sous l’effet de la chaleur, le
carbone va se dissocier et former une couche monoatomique à la surface du
cuivre (nucléation). En refroidissant rapidement, on finit par obtenir la
structure hexagonale du graphène.

L’enjeu
principal de la synthèse du graphène est de former du graphène monocouche avec
le moins de défauts structurels possibles.
Mécanisme
de croissance du graphène
La
croissance CVD du graphène sur différents métaux de transition est possible et
a été étudiée dans la littérature. Parmi ces métaux de transition, on peut
citer le ruthénium, le nickel, l’iridium et le cuivre.
Il
existe deux mécanismes de croissance possible pour le graphène CVD :
- l’un impliquant la migration du
carbone adsorbé à la surface,

- l'autre faisant intervenir d'abord
une dissolution du carbone adsorbé dans le matériau puis sa précipitation à la
surface lors du refroidissement.
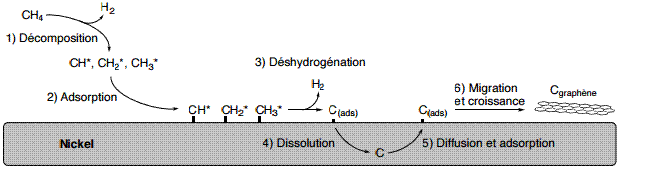
CH*, CH2
* et CH3 * sont des espèces actives sous forme de carbanions ou de
radicaux. C(ads), carbone adsorbé sur la surface du métal.
1-2-2) Caractérisation
La
caractérisation du graphène, après croissance, se fait par la spectroscopie
Raman. Cette méthode, complémentaire de la spectroscopie infrarouge, est basée
sur la diffusion élastique des radiations.
Le
graphène peut présenter trois bandes :
- une
bande D autour de 1350 cm–1 qui caractérise la présence de défauts
cristallographiques et d'impuretés dans le matériau,
- une
bande G autour de 1600 cm–1 et une bande 2D autour de 2700 cm–1
caractéristiques du graphène.
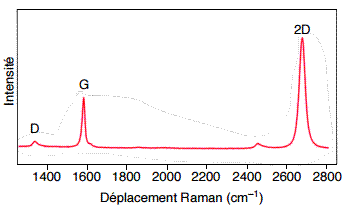
Le
ratio IG/I2D des intensités des pics G et 2D donne une
estimation du nombre de couches dans la zone d’étude. Ainsi pour IG/I2D
< 1 on a pratiquement une monocouche de graphène tandis que pour IG/I2D
> 1 on a des structures multicouches. Le ratio ID/IG
des intensités des pics G et D permet d'estimer la densité de défauts présents
dans la couche de graphène.
1-3) Exfoliation
du graphite par fonctionnalisation du graphène selon la réaction de Diels-Alder
Une
méthode chimique peut également être employée pour produire du graphène via une
réaction Diels-Alder réversible à partir du graphite.
Le
graphite est mis en réaction avec le tétracyanoéthylène (TCNE) conduisant à des
adduits de Diels-Alder graphite-TCNE par formation de liaisons covalentes sur
les feuilles de graphène :
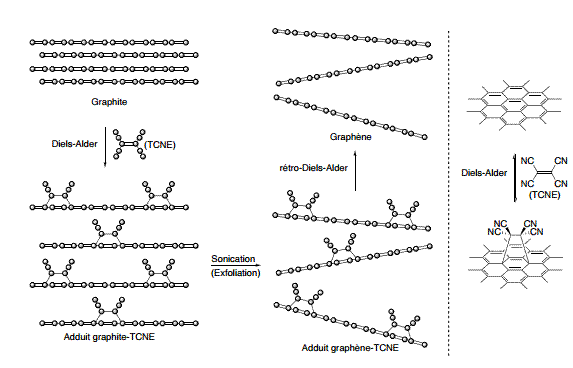
La
fixation de ces groupements volumineux sur les feuillets de graphène entraine
l’éloignement des feuillets et permet une exfoliation mécanique par sonication
en adduits de graphène-TCNE. Le graphène pur peut ensuite être récupéré par une
réaction de rétro-DielsAlder par chauffage à 100°C des adduits de
graphène-TCNE.
Z.
Ji, J. Chen, L. Huang, G. Shi, Chem. Commun. 2015, 51, 2806–2809.
1-4) Une
application du graphène Dans
les batteries lithium-ion
Les
batteries utilisées couramment dans les véhicules électriques, mais également
dans d'autres applications comme les téléphones portables, sont de type
lithium-ion. Elles présentent l'avantage d'avoir une très grande énergie
massique, comprise entre 90 et 180 Wh·kg−1 . De plus, ces
batteries, même partiellement déchargées, délivrent toujours la même puissance,
ce qui permet une utilisation dans les mêmes conditions, quel que soit le
niveau de charge. Le principe général d’une batterie lithium-ion est basé sur
l’échange réversible des ions lithium entre une électrode positive en oxyde
métallique (MO2) et une électrode négative en graphite qui va stocker les ions
lithium pendant la charge.
Représentation
schématique d’une batterie Li-ion
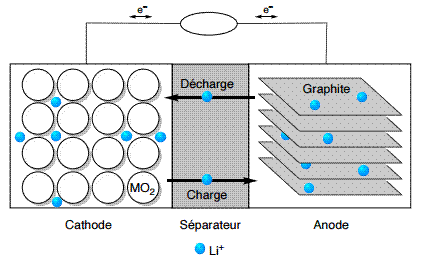
Les
principales caractéristiques d’une batterie Li-ion présente dans le véhicule
électrique sont les suivantes :
- Énergie utilisable (kWh) 41
- Tension totale (V) 400
- Nombre de cellules 192
- Masse de la batterie (kg) 305
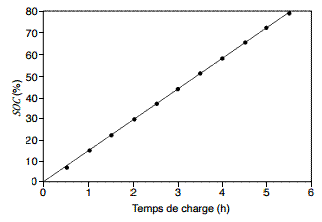
Une des
caractéristiques essentielles d’une batterie est son état de charge SOC (State
Of Charge) et sa variation en fonction du temps.
Il
varie de 0 % (batterie déchargée) à 100 % (batterie entièrement chargée).
Le SOC
est directement lié à l'énergie emmagasinée par la batterie. L'énergie maximale
qui peut être emmagasinée représente son énergie utilisable.
![]()
Pour la
batterie considérée, la variation du SOC en fonction du temps de charge de la
batterie est donnée dans la figure suivante :
Récemment,
Wang et coll., en utilisant une anode composée de feuillets de graphène et de
SnO2 sont parvenus à réaliser une batterie dont la capacité spécifique est de
635 mA·h·g–1 après 100 cycles charge/décharge, la capacité
spécifique étant à l’origine de 784 mA·h·g–1 ( D. Wang, X. Li, J.
Wang, J. Yang, D. Geng, R. Li, M. Cai, T.-K. Sham, X. Sun, J. Phys. Chem.
C 2012, 116, 22149–22156).
La
diminution de la capacité spécifique est liée à la grande surface spécifique du
graphène et est due à la perte irréversible d’ions lithium, du fait de à la décomposition
de l’électrolyte, qui précipite et passive la surface de l’anode accessible
pour la lithiation.
2) Les nanotubes
Les nanotubes sont principalement constitués de carbone.
Ils se forment à partir de feuilles de graphène, une structure
plane composée d'atomes de carbone hybridés sp2 agencés en
hexagones.
Ces feuilles de graphène sont enroulées de manière à former des
cylindres fermés à leurs deux extrémités par des demi-sphères.
Il existe deux principaux types de nanotubes de carbone : ceux à
paroi unique, Singled-walled Carbon Nanotubes (SWCNT) et ceux à paroi
multiple Multi-walled Carbon Nanotubes (MWCNT).
Les SWCNT sont constitués d'un seul cylindre de graphène, tandis
que les MWCNT comprennent plusieurs cylindres concentriques.
- Nanotubes à
paroi unique :
L'axe selon lequel est enroulé la feuille de graphène définit
l'hélicité du nanotube c'est-à-dire sa structure.
Trois types d'enroulement :
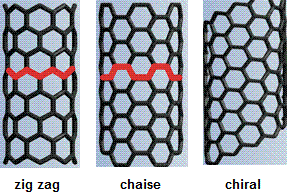
(images captées sur le site Société chimique de France : Nanotubes
et catalyse hétérogène)
- Nanotubes à
paroi multiple :
Il existe deux modèles pour décrire leur structure :
·
le modèle poupées russes,
les feuillets de graphène sont enroulés en cylindres concentriques.
·
le modèle parchemin, un
seul feuillet de graphène est enroulé sur lui-même.
Les demi-sphères qui obturent les cylindres sont obtenues en
introduisant des défauts de topologies du feuillet de graphène c'est-à-dire des
discontinuités dans la structure hexagonale régulière comme des pentagones ou
des heptagones ; On montre qu'il faut 6 pentagones réguliers à chaque extrémité
pour obturer un nanotube fermé par des hémisphères (demi-fullerènes). En
pratique on observe le plus souvent une pointe conique à l'extrémité, preuve
que les pentagones ne sont pas réguliers.
La longueur des nanotubes peut atteindre plusieurs micromètres,
tandis que leur diamètre est de 1 à 2 nanomètres pour les SWCNT et de quelques
dizaines de nanomètres pour les MWCNT.
Ils présentent des propriétés exceptionnelles en raison de leur
taille nanométrique.
Utilisés dans divers domaines tels que l'électronique, les
matériaux composites et la médecine, les nanotubes offrent un potentiel
révolutionnaire grâce à leur résistance mécanique, leur conductivité électrique
et leurs propriétés chimiques uniques.
Résistance mécanique :
Ils peuvent supporter des
charges importantes sans se rompre ; cette résistance est due à la structure
hexagonale des feuilles de graphène et aux liaisons extrêmement fortes entre
les atomes de carbone. Ils sont également très flexibles sans déformations
permanentes. Ils sont mis à profit par exemple pour renforcer un assemblage de
matériaux composites.
Conductivité électrique :
Elle dépend du type d'enroulement
des feuillets de graphène.
Deux types principaux :
- Les nanotubes
dits métalliques qui ont une conductivité électrique supérieure à celle de certains métaux, cuivre
par exemple ; les électrons se déplacent très facilement le long de leur structure
tubulaire.
- Les nanotubes
semi-conducteurs qui ont une bande interdite plus importante et présentent des
propriétés électriques similaires à celles des semi-conducteurs.
- A basse
température ils sont supraconducteurs.
C'est leur hélicité qui conditionne leurs propriétés électriques,
ils sont conducteurs ou semi-conducteurs, avec un "gap" (voir annexe 1) semblable à celui du silicium, bien connu dans
les circuits électroniques.
Ces propriétés font qu'ils peuvent être intégrés à des circuits
électroniques en tant que diodes ou transistors, ou encore être utilisés dans
la réalisation d'écrans plats comme source d'électrons.
Propriétés optiques :
Un rideau de nanotubes disposés verticalement constitue
pratiquement un "corps noir". Il absorbe 99,9 % de la lumière qu'il
reçoit.
De nombreux domaines peuvent être intéressés par cette propriété :
domaine de l'énergie solaire, de la communication, des colorants ….
Utilisations en chimie et dans le domaine médical :
- En chimie, les
nanotubes de carbone sont utilisés comme catalyseurs dans des réactions
chimiques spécifiques en raison de leur structure offrant une grande surface
active. Ils sont également employés comme supports pour les catalyseurs
métalliques, améliorant ainsi leur stabilité et leur efficacité.
On a pu par exemple hydrogéner sélectivement du
3-méthyl-but-2-ènal en 3-méthyl-but-2-ènol, sans affecter la double liaison,
avec comme catalyseur un hybride Pt-SWCNT :
![]()
On a pu aussi oxyder sélectivement des alcools primaires en aldéhydes ou en acides carboxyliques selon
les conditions opératoires en utilisant des assemblages Au-NTC (or-nanotubes de
carbone).
Exemple : oxydation de l'alcool benzylique
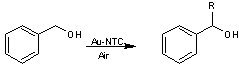
avec R = H en l'absence d'eau (aldéhyde benzylique)
et R = OH en présence
d'eau (acide benzoïque)
- Dans le domaine
médical, les nanotubes de carbone sont intéressants pour leur capacité à
fonctionner comme vecteurs de médicaments. Leur structure tubulaire creuse
permet de transporter des agents thérapeutiques directement vers des cellules
cibles, améliorant la précision du traitement.
De plus, les nanotubes de carbone sont étudiés pour leur
utilisation dans l'imagerie médicale, notamment en tant qu'agents de contraste
pour améliorer la visibilité des tissus lors d'examens diagnostiques.
Dans toutes ces applications, il est nécessaire de manipuler
facilement ces nanotubes. On a dans la plupart des cas contourné l'obstacle
provenant de leur absence de solubilité dans les milieux aqueux et la plupart
des milieux organiques en "fonctionnalisant" ces nanotubes.
(images captées sur le site Société chimique de France : Nanotubes
et catalyse hétérogène)
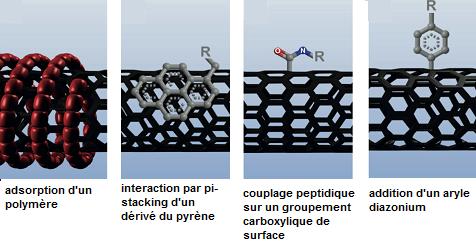
La fonctionnalisation des
nanotubes consiste à placer à leur surface, des molécules qui vont leur
donner de nouvelles propriétés.
Deux types de fonctionnalisation :
- fonctionnalisation
non covalente : les interactions entre les molécules placées à la surface
et le nanotube sont des interactions de Van der Walls, ou hydrophobes, ou par
π-stacking (voir les deux premières images ci-dessus).
- fonctionnalisation
covalente : on peut en traitant les nanotubes par de l'acide sulfurique ou
nitrique oxyder quelques atomes de carbone de surface et obtenir des fonctions
carboxyliques (qui rendront ces nanotubes solubles en milieu aqueux), phénols
ou cétones.
Les fonctions carboxyliques permettront par exemple de greffer
différentes fonctions (3ème image, couplage peptidique et 4ème
image, addition d'un aryle diazonium).
2-3) Préparation des nanotubes de carbone :
Il existe plusieurs méthodes de fabrication des nanotubes de
carbone (NTC), en voici quelques-unes :
- Méthode à l'arc électrique
(Arc Discharge) :
Elle implique la création d'un arc électrique entre deux électrodes en graphite
dans une atmosphère contrôlée (hélium ou argon).
Les NTC sont formés sur l'électrode négative à des températures
élevées (6000°C).
- Méthode par ablation
laser (Laser Ablation) :
Utilisation d'un laser de forte énergie pour vaporiser une cible en graphite
dans un environnement contenant des gaz inertes (argon).
Les NTC se forment à partir des particules vaporisées.
- Dépôt chimique en phase
vapeur (CVD - Chemical Vapor Deposition) :
Les NTC sont synthétisés à partir de gaz contenant des précurseurs de carbone
(Méthane, éthane, acétylène), déposés sur un catalyseur (Fer, cobalt,nickel).
Ces catalyseurs sont généralement déposés sur un substrat, tel que
de l'oxyde de silicium (SiO₂), et
sont chauffés à des températures élevées dans un environnement contenant le
précurseur de carbone gazeux. Les catalyseurs favorisent la dissociation du
précurseur de carbone, et le carbone résultant se dépose sur les catalyseurs
sous forme de nanotubes.
Le choix spécifique des précurseurs et des catalyseurs peut influencer les
propriétés des nanotubes produits, tels que leur diamètre, leur structure, et
leurs propriétés électroniques.
Cela peut être réalisé en phase gazeuse ou en utilisant des précurseurs
liquides.
- Méthode de décharge
électrothermique (HiPco - High-Pressure Carbon Monoxide) :
On crée un arc électrique entre deux électrodes de graphite
contenant des catalyseurs métalliques (Fe, Co, Ni), dans une atmosphère de
monoxyde de carbone (CO) à haute pression.
Le monoxyde de carbone se décompose sous l'effet de l'arc
électrique et le carbone résultant se dépose sur les catalyseurs pour former des
nanotubes de haute pureté avec des diamètres relativement uniformes.
- Méthode des nanotubes de
carbone en lit fluidisé (CCVD - Fluidized Bed CVD) :
La méthode en lit fluidisé est une technique de synthèse des nanotubes de
carbone (NTC) qui implique l'utilisation d'un gaz porteur pour maintenir les
catalyseurs en suspension pendant la croissance des NTC1.
Principe
de fonctionnement :
Des catalyseurs métalliques, tels que le fer, sont déposés sur un support
solide, généralement sous forme de particules fines. Ces particules
catalytiques sont ensuite placées dans un réacteur.
Un gaz porteur, souvent de l'hydrogène (H₂) ou un mélange de gaz, est introduit dans le réacteur. Ce gaz
maintient les particules catalytiques en suspension, créant un lit fluidisé.
Un précurseur de carbone, tel que le méthane (CH₄) ou un autre composé carboné, est introduit dans le réacteur.
Le réacteur est chauffé à des températures élevées, généralement entre 700 et
1000 °C.
Les catalyseurs métalliques facilitent la décomposition du précurseur de
carbone, favorisant la croissance des nanotubes.
Les nanotubes de carbone se forment sur les catalyseurs en suspension et sont
collectés à la fin du processus.
Avantages :
La méthode en lit fluidisé offre une distribution uniforme des catalyseurs, ce
qui peut conduire à des nanotubes avec des propriétés plus homogènes.
Elle permet un contrôle précis des conditions de croissance.
Applications :
Cette méthode est utilisée dans la production à grande échelle de nanotubes de
carbone en raison de sa capacité à maintenir une dispersion homogène des
catalyseurs.
Ces méthodes
varient en termes de coût, de rendement, de contrôle de la structure des
nanotubes, et de la possibilité de produire des nanotubes avec des propriétés
spécifiques. Le choix de la méthode dépend souvent des besoins de l'application
envisagée.
2-4) Remarque : Nanotubes et santé
Les nanotubes de carbone (NTC) suscitent des préoccupations en
matière de santé en raison de leur structure.
Les principaux problèmes associés aux NTC comprennent notamment :
- Une toxicité pulmonaire :
Des études animales ont montré que l'inhalation de nanotubes de carbone peut
entraîner une inflammation pulmonaire, des lésions et des réponses immunitaires
anormales.
- Un potentiel cancérogène :
Certains travaux de recherche ont suggéré que les nanotubes pourraient
présenter un risque de cancer, principalement lié à leur capacité à induire une
fibrose pulmonaire.
Il est important de noter que la recherche sur les effets des nanotubes de
carbone sur la santé est un domaine en évolution, et la compréhension des
risques potentiels continue d'évoluer. Des mesures de précaution sont
recommandées dans la manipulation et l'exposition aux nanotubes de carbone,
surtout dans des environnements industriels où ils sont produits ou utilisés.
Notion de "gap"
Le
"gap" pour le silicium fait référence à la bande interdite d'énergie,
souvent appelée simplement la "bande interdite". C'est l'écart
d'énergie entre la bande de valence, où les électrons sont liés aux atomes, et
la bande de conduction, où les électrons sont libres de se déplacer et de
participer à la conduction électrique.
Dans le cas du silicium, un semi-conducteur, cette bande interdite détermine
ses propriétés électriques. La largeur de cette bande interdite influence la
capacité du matériau à conduire l'électricité. Le silicium a une bande
interdite d'énergie d'environ 1,1 électron-volt (eV). Des matériaux avec des
bandes interdites plus étroites sont généralement de meilleurs conducteurs, tandis
que ceux avec des bandes interdites plus larges sont souvent des isolants.