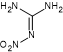LES AIRBAGS
Plan
de l’étude :
1) Introduction
3-1) Historiquement,
la première réaction
3-2) Le sodium
métallique produit
3-3) Autres
réactions utilisées
Les airbags font partie
intégrante des systèmes de sécurité passive des véhicules automobiles ;
ceux équipés d’airbags ont un taux de mortalité réduit de 30 % par
rapport à ceux qui n’en sont pas équipés.
Leur efficacité repose sur un
déploiement ultra-rapide (en quelques millisecondes seulement) d’un coussin en
cas de choc. Une réaction chimique contrôlée conduit à un dégagement gazeux
suffisamment rapide et abondant pour que le coussin se gonfle instantanément.
2) Principe de fonctionnement :
Un airbag est un sac replié et
dissimulé dans le volant, le tableau de bord ou les portières. Lors d’un
accident, des capteurs détectent une décélération brutale. Si elle dépasse un
certain seuil (généralement >25 km/h en 50 millisecondes), un signal électrique
est envoyé à un détonateur pyrotechnique (voir annexe
1) qui déclenche une réaction chimique explosive.
3) Réactions chimiques :
3-1) Historiquement,
la première réaction qui a été mise en œuvre est la décomposition de
l’azoture de sodium (NaN₃), une
substance instable, sensible aux chocs, à la chaleur et aux frottements.
![]()
- Cette réaction produit un grand
volume d’azote (N₂) quasi
instantanément.
- Elle est exothermique.
- Le gaz gonfle le sac en moins de 30
millisecondes, amortissant le choc et protégeant les passagers.
- En même temps, du sodium métal se forme.
3-2) Le sodium
métallique produit
Le sodium
(Na) produit est un métal très réactif et potentiellement dangereux. Pour
éviter les risques (réaction violente avec l'humidité), il est
immédiatement neutralisé par des agents oxydants dans des réactions
secondaires qui transforment le sodium en composés solides
inoffensifs comme des silicates ou des oxydes de sodium, piégés dans un
résidu poudreux.
Exemple d’oxydants utilisés :
- Nitrate de potassium (KNO₃)
![]()
K2O et Na2O
réagissent ensuite avec du
- Dioxyde de silicium (SiO₂).
![]()
un composé
inoffensif.
3-3) Autres réactions
utilisées
L’azoture de sodium (NaN3)
n’est plus utilisé de nos jours.
Au cours du temps plusieurs
composés ont été essayés et mis en œuvre. La liste suivante est par ordre
chronologique, à savoir que les plus anciens sont dans le haut du tableau.
|
KN3 Azoture
de potassium |
Rarement utilisé de nos jours |
L’équation
de décomposition de KN3 est tout à fait comparable à celle de NaN3
|
|
Guanidine
et nitroguanidine |
Couramment utilisés avec …. |
Oxydant : Nitrate de potassium
(KNO3) Neutralisant : hydrogénocarbonate de
sodium Agent de fluidité : silice (SiO2). |
|
CH2N4 Tétrazole |
Utilisé avec …. |
Oxydant : Nitrate de potassium
(KNO3) Neutralisant : hydrogénocarbonate de
sodium Agent de fluidité : silice (SiO2). |
Détonateur pyrotechnique
Un
airbag comporte un capteur d’accélération capable de détecter une décélération
brutale ; il s’agit d’un dispositif piézoélectrique ; une masse sous
l’action de la décélération exerce une force sur un cristal ; Cette
compression provoque une polarisation électrique de celui-ci (effet
piézoélectrique) qui déclenche une impulsion électrique transmise à un
circuit comprenant un filament qui s’échauffe et fait exploser un mélange très
sensible (détonation primaire) à base
- Soit de styphnate
de plomb (sel de plomb de l’acide styphnique)
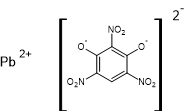 qui se décompose à partir de 225°C
en libérant du plomb, de l’azote, de l’oxyde et du dioxyde de carbone, vapeur
d’eau et parfois des Nox (oxydes d’azote).
qui se décompose à partir de 225°C
en libérant du plomb, de l’azote, de l’oxyde et du dioxyde de carbone, vapeur
d’eau et parfois des Nox (oxydes d’azote).
- Soit de tétrazène
explosif
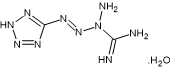 qui sous l’effet de la chaleur se décompose en
libérant du diazote, de l’oxyde et du dioxyde de carbone, de la vapeur d’eau et
parfois de l’ammoniac ou des Nox (oxydes d’azote).
qui sous l’effet de la chaleur se décompose en
libérant du diazote, de l’oxyde et du dioxyde de carbone, de la vapeur d’eau et
parfois de l’ammoniac ou des Nox (oxydes d’azote).
La
réaction exothermique conduit alors à la violente décomposition de l’explosif
que contient l’airbag.