PYRETHRINES ET PYRETHROÏDES
Plan
de l’étude
1) Introduction
2-1) Deux pyréthrines
2-2) Deux pyréthroïdes
3-1) Mode d’action
3-2) Avantages
4-1) Structure
chimique
4-2) Quelques
pyréthroïdes de type I
4-3) Quelques pyréthroïdes de type II
4-4) Mode d’action
4-7)
Environnement et toxicité
Les pyréthrines et les pyréthroïdes que l’on désigne
parfois par le terme générique « pyréthrinoïdes », constituent deux grandes
familles d’insecticides largement utilisées en agriculture, en santé publique
(lutte contre les moustiques vecteurs du paludisme, de la dengue, du zika ou du chikungunya) et en protection domestique (bombes
insecticides, diffuseurs électriques à base de pyréthrinoÏdes
…). Bien que partageant une structure chimique et un mode d’action similaires,
ces composés diffèrent par leur origine : les pyréthrines sont des
substances naturelles extraites des fleurs de certaines espèces de
chrysanthèmes (Chrysanthemum cinerariifolium), tandis que
les pyréthroïdes sont des analogues de synthèse développés
pour améliorer la stabilité et l’efficacité des pyréthrines. Cette parenté
chimique leur confère une action neurotoxique rapide sur les insectes, tout en
maintenant, pour beaucoup d’entre eux, une toxicité relativement faible chez
les mammifères.
Pyréthrines et
pyréthroïdes sont tous des esters ; prenons deux exemples de pyréthrines
et deux exemples de pyréthroïdes et examinons leur structure :
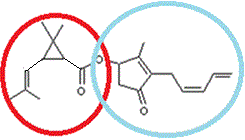
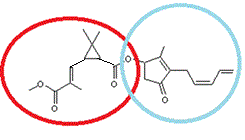
2-1) Deux pyréthrines
|
La pyréthrine I (ou
version I) |
|
La
pyréthrine II (ou version II) |
|
|
|
|
|
|
|
|
La
partie entourée en rouge est la partie acide de l’ester. Il s’agit ici de l’acide
chrysantémique. La
partie entourée en bleu-vert est la partie alcool de l’ester.Il s’agit ici de
L’alcool
pyréthrolone. |
|
La
partie entourée en rouge est la partie acide de l’ester. Il s’agit ici de l’acide
pyréthrique La
partie entourée en bleu-vert est la partie alcool de l’ester.Il s’agit ici de
L’alcool
pyréthrolone. |
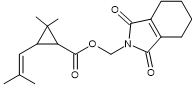
2-2) Deux pyréthroïdes
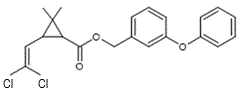
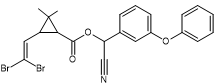
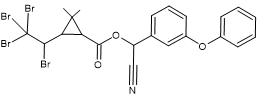
La perméthrine La
cyperméthrine
|
C’est un pyréthroïde de
type I |
La
partie entourée en rouge est la partie acide de l’ester. Il s’agit ici d’un
dérivé halogéné de l’acide chrysantémique : l’acide
3-(2,2-dichlorovinyl)-2,2-diméthylcyclopropane-1-carboxylique. La
partie entourée en bleu-vert est la partie alcool de l’ester.Il s’agit ici de
l’alcool 3- phénoxybenzylique |
|
La
partie entourée en rouge est la partie acide de l’ester. Il s’agit ici de
l’acide 3-(2,2-dichlorovinyl)-2,2-diméthylcyclopropane-1-carboxylique. La
partie entourée en bleu-vert est la partie alcool de l’ester.Il s’agit ici de
l’alcool α-cyano-3-phénoxybenzylique |
Ainsi qu’il a été dit
dans l’introduction, les pyréthrines sont des substances naturelles.
Elles sont utilisées
depuis des siècles comme insecticides en raison de leur efficacité et
de leur relative innocuité pour l’homme.
Les pyréthrines sont
présentes dans les fleurs séchées de certaines espèces de
chrysanthèmes.
Elles sont extraites
mécaniquement ou chimiquement, puis purifiées pour être intégrées à des
produits insecticides.
Les principaux pays
producteurs sont : le Kenya, la Tanzanie, la Chine, et l’Australie.
Il existe six
pyréthrines naturelles : pyréthrine I et II, cinérine
I et II, jasmoline I et II.
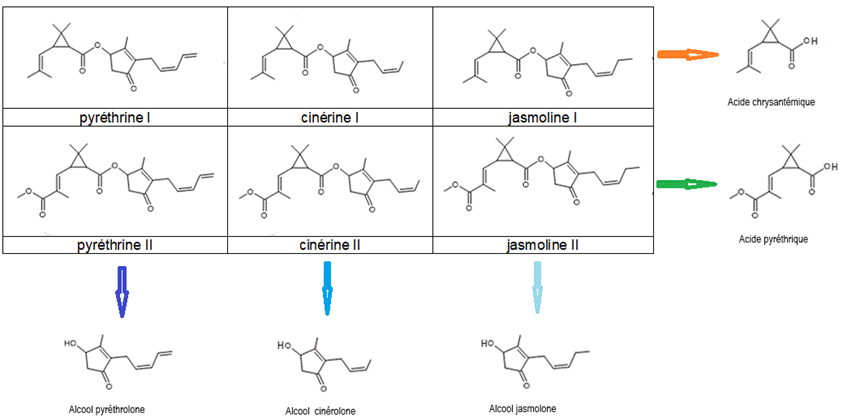
On remarque que
pyréthrine, cinérine, et jasmoline
de version I sont des esters issus du même acide, l’acide chrysantémique.
On remarque que
pyréthrine, cinérine, et jasmoline
de version II sont des esters issus du même acide, l’acide pyréthrique.
On remarque aussi que
les deux versions d’une même pyréthrine (par exemple cinérine
I et cinérine II) sont des esters issus d’un même
alcool.
Ainsi :
- pyréthrine I et
II sont issus de l’alcool pyréthrolone
- cinérine I et II sont issus de l’alcool cinérolone
- Jasmoline I et II sont issus
de l’alcool jasmolone
Leur structure chimique
complexe est à la base de leur activité neurotoxique sur les insectes.
- Les
pyréthrines agissent sur le système nerveux des insectes, en
perturbant les canaux sodiques des cellules nerveuses.
- Cela
provoque des paralysies rapides et la mort de
l’insecte.
- Elles
sont efficaces par contact et agissent rapidement, mais leur
effet est de courte durée (faible rémanence).
- Insecticides
ménagers (sprays, diffuseurs, bombes anti-moustiques).
- Produits
agricoles bio ou en lutte intégrée (car d’origine
naturelle).
- Traitement
des animaux domestiques contre les puces ou les poux.
3-2) Avantages
- Ces
substances sont d’origine naturelle, donc biodégradables et moins
polluantes.
- Elles
ont une faible toxicité pour les mammifères et les oiseaux.
- Il
n’y a que peu de résidus sur les cultures ; les niveaux détectés sur
les produits agricoles (grains,légumes, fruits à coque ….) sont nettement
inférieurs aux limites maximales réglementaires (LMR), souvent plus de 10
à 20 fois en dessous.
·
Sensibles
à la lumière (UV) et à l’air, les pyréthrines se dégradent vite (d’où l’ajout
parfois de synergistes comme le butoxyde de
pipéronyle PBO).
Remarque :
L’action du butoxyde de pipéronyle
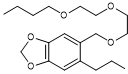
est de bloquer chez les
insectes certaines enzymes (cytochromes P 450 monooxygénases) qui peuvent
décomposer rapidement les pyréthrines, les rendant inefficaces. Il n’a par
contre aucune activité insecticide.
·
Ils
se montrent peu efficaces sur certains insectes résistants (Moustique commun et
moustique tigre, punaise de lit.)
·
Etant
peu persistants, ils nécessitent des applications fréquentes.
4) Les
pyrèthroïdes
On a créé des versions synthétiques, pour
améliorer l’efficacité des pyréthrines ; ce sont les pyrèthroïdes. Deux exemples ont été donnés en introduction,
ce sont la perméthrine et la cyperméthrine.
Ce sont des insecticides plus stables, plus puissants,
mais parfois plus toxiques pour l’environnement aquatique que les pyréthrines.
Ils sont largement utilisés dans l’agriculture, la santé publique
et la protection des habitations.
4-1) Structure chimique
Tout comme les pyréthrines, les pyrèthroïdes
contiennent un noyau cyclopropane et un groupe ester.
- Il
existe des pyrèthroïdes de type I, sans groupe cyano : c’est le cas de la perméthrine
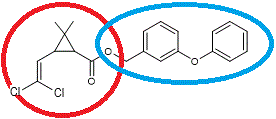
- Il existe des pyrèthroïdes de type II, avec un groupe cyano : c’est le cas de
la cyperméthrine
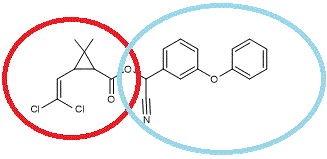
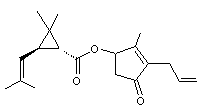
4-2)
Quelques pyréthroïdes de type I
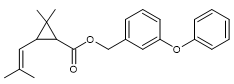
|
Acide : Acide chrysantémique Alcool : Alléthrolone |
Acide : dérivé halogéné de l’acide chrysantémique Alcool : 3-(2-méthylphényl)phénylméthanol |
|
Stéréo-isomère de l’alléthrine. |
Acide : dérivé halogéné de l’acide chrysantémique. Alcool :
3- phénoxybenzylique |
|
ou Sumithrine
Acide : Acide chrysantémique Alcool :
3- phénoxybenzylique |
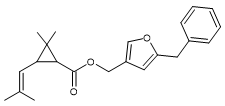
Alcool :
(5-benzyl-3-furyl)méthanol |
|
Acide : dérivé halogéné de l’acide chrysantémique. Alcool :
(2,3,5,6-tétrafluorophényl) méthanol |
Acide : Acide chrysantémique Alcool :
|
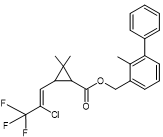
4-3) Quelques pyréthroïdes de
type II
Ils possèdent tous un groupe α-cyané
|
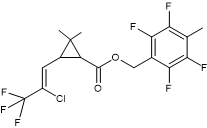
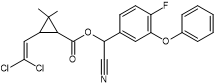
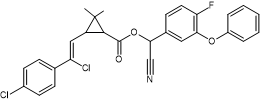
Acide : dérivé halogéné de l’acide chrysantémique. Alcool :
α-cyano-4-fluoro-3-phénoxybenzylique |
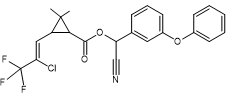
Acide : dérivé halogéné de l’acide chrysantémique. Alcool : α—cyano-3- phénoxybenzylique |
|
Acide : dérivé halogéné de l’acide chrysantémique. Alcool :
Alcool α-cyano-3-phénoxybenzylique |
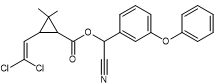
Acide : dérivé halogéné de l’acide chrysantémique. Alcool :
Alcool α-cyano-3-phénoxybenzylique |
|
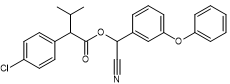
Acide :
Acide 2-(4-chlorophényl)-3-méthylbutanoïque Alcool :
Alcool α-cyano-3-phénoxybenzylique |
Fluméthrine
Acide : 3-[-2-chloro-2-(4-chlorophényl)éthényl]-2,2-diméthylcyclopropane-1-carboxylique Alcool :
α-cyano-4-fluoro-3-phénoxybenzylique |
|
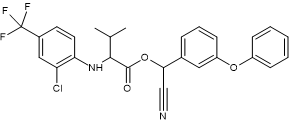
Acide :
2-(2-chloro-4-trifluorométhylphényl)amino-3-méthylbutanoïque. Alcool :
Alcool α-cyano-3-phénoxybenzylique |
Acide :2,2-diméthyl-3-(1,2,2,2-tétrabromoéthyl)cyclopropane-1-carboxylique. Alcool :
Alcool α-cyano-3-phénoxybenzylique |
4-4) Mode
d’action
Les pyrèthroïdes
ciblent le système nerveux des insectes.
Ils perturbent les
canaux sodiques (Na⁺) des cellules nerveuses → cela
provoque des décharges électriques incontrôlées → paralysie → mort
de l’insecte.
Les pyrèthroïdes
de type I ont un effet "knockdown" rapide (chute immédiate de
l’insecte).
Les pyrèthroïdes
de type II ont un effet plus prolongé, paralysant.
De nombreux insectes
développent une résistance :
- Mutation des canaux sodiques (kdr (knockdown resistance)),
- Enzymes détoxifiantes ;
Les enzymes détoxifiantes sont produites par certains insectes
pour neutraliser ou éliminer les insecticides avant qu’ils
n’atteignent leur cible. Elles jouent un rôle clé dans la résistance
métabolique.
- Modification comportementale.
Certaines espèces
deviennent très résistantes : moustiques (Culex, Anopheles), blattes, punaises de lit.
-
Agriculture : lutte contre les pucerons, chenilles,
coléoptères…
-
Hygiène publique : traitement des moustiques, punaises de
lit.
-
Animaux domestiques : anti-puces
pour chiens (mais toxiques pour les chats !).
-
Usage domestique : bombes aérosols, diffuseurs,
moustiquaires imprégnées.
4-7) Environnement et
toxicité
- Faible toxicité pour l’homme à
faibles doses, mais :
- Très toxiques pour les poissons,
invertébrés aquatiques, et abeilles.
- Résidus possibles dans les sols ou
sur les aliments.
- Non autorisés en agriculture
biologique.